
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是
A. 常温下将pH=3的 HCOOH溶液和pH=11氨水等体积混合后溶液呈碱性
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COOH) > c(Cl- ) > c(CH3COO-) > c(H+)
【答案】A
【解析】A项,Ka(HCOOH)![]() Kb(NH3·H2O),常温下pH=3的HCOOH溶液物质的量浓度小于pH=11的氨水溶液物质的量浓度,pH=3的HCOOH溶液和pH=11的氨水溶液等体积混合,反应后氨水过量,溶液呈碱性,正确;B项,Ka(HCOOH)
Kb(NH3·H2O),常温下pH=3的HCOOH溶液物质的量浓度小于pH=11的氨水溶液物质的量浓度,pH=3的HCOOH溶液和pH=11的氨水溶液等体积混合,反应后氨水过量,溶液呈碱性,正确;B项,Ka(HCOOH)![]() Ka(CH3COOH),pH=3的HCOOH溶液物质的量浓度小于CH3COOH溶液物质的量浓度,等体积pH均为3的HCOOH溶液消耗的NaOH小于CH3COOH溶液,错误;C项,0.2mol/LHCOOH与0.1mol/LNaOH溶液等体积混合后得到等物质的量浓度的HCOOH和HCOONa的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(HCOO-)+c(OH-),物料守恒为2c(Na+)=c(HCOOH)+c(HCOO-),两式整理得c(HCOO-)+2c(OH-)=c(HCOOH)+2c(H+),错误;D项,0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后得到等物质的量浓度的CH3COOH、NaCl和CH3COONa的混合液,溶液的pH
Ka(CH3COOH),pH=3的HCOOH溶液物质的量浓度小于CH3COOH溶液物质的量浓度,等体积pH均为3的HCOOH溶液消耗的NaOH小于CH3COOH溶液,错误;C项,0.2mol/LHCOOH与0.1mol/LNaOH溶液等体积混合后得到等物质的量浓度的HCOOH和HCOONa的混合液,溶液中的电荷守恒为c(Na+)+c(H+)=c(HCOO-)+c(OH-),物料守恒为2c(Na+)=c(HCOOH)+c(HCOO-),两式整理得c(HCOO-)+2c(OH-)=c(HCOOH)+2c(H+),错误;D项,0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后得到等物质的量浓度的CH3COOH、NaCl和CH3COONa的混合液,溶液的pH![]() 7说明CH3COOH的电离程度大于CH3COO-的水解程度,溶液中粒子浓度由大到小的顺序为:c(Na+)
7说明CH3COOH的电离程度大于CH3COO-的水解程度,溶液中粒子浓度由大到小的顺序为:c(Na+)![]() c(CH3COO-)
c(CH3COO-)![]() c(Cl-)
c(Cl-)![]() c(CH3COOH)
c(CH3COOH)![]() c(H+)
c(H+)![]() c(OH-),错误;答案选A。
c(OH-),错误;答案选A。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】甲烷在氧气中燃烧后生成二氧化碳和水,从该实验事实可以得出的结论是( )
A.甲烷的分子式为CH4B.甲烷气体中含碳元素和氢元素
C.甲烷分子中只含碳元素和氢元素D.甲烷的化学性质比较稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准盐酸滴定未知浓度的氨水溶液(锥形瓶中)时,下列说法正确的是
A. 量取一定体积的氨水用如右图所示仪器![]()
B. 从测定结果的准确性考虑,选择酚酞作指示剂比选甲基橙要好
C. 滴定前滴定管的尖嘴处有气泡,而在滴定后气泡消失,则测定氨水的浓度偏高
D. 滴定过程中,往锥形瓶中加入少量蒸馏水会导致测定的浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化关系中,需要加入氧化剂才能实现的是( )
A.Na2O2→O2
B.MnO4﹣→Mn2+
C.Fe2+→Fe3+
D.CO2→HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.3 | 4.0 | 7.6 | 8.4 |
完全沉淀pH | 4.1 | 5.2 | 9.6 | 10.8 |
根据题意回答下列问题:
(1)请提出两条加快酸解速率的措施__________________。
(2)滤渣的主要成分除MnO2及矿物中其他不溶性杂质外还有_____________ (填化学式),写出生成MnO2的离子方程式_____________ 。
(3)在除去滤渣之前,往往还加一定物质再次调节pH,请选择合适的物质________
A.NaOH B.MgO C.Mg(OH)2 D.氨水
根据表格给出数据写出调节pH的范围___________。
(4)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 20 | 50 | 60 | 70 |
MgSO4 | 25.0 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgS4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤___________。再将滤液进行“操作1”,则析出晶体后的溶液(20℃) 中,C(Mg2+)=___________mol/L(该混合溶液的密度为1.2g·cm-3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60的发现为纳米科学提供了重要的研究对象,下列关于C60的说法正确的是( )
A.C60是一种新型化合物B.C60的摩尔质量是720
C.C60是一种混合物D.C60与金刚石都是碳的同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法,如图所示的两个装置都可以制取蒸馏水。
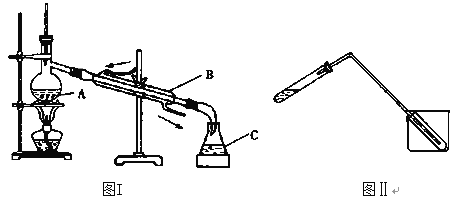
(1)图I是实验室制取蒸馏水的常用装置,仪器A的名称是________________,加热A时要加垫石棉网,目的是_______________。
(2)水的流向是否正确?________(填“正确”或“不正确”)
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是____________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。
I.(1)工业上用N2和H2在一定条件下合成氨,下列措施能使正反应速率增大,且使平衡混合物中NH3的体积分数一定增大的是______。
A.降低反应温度 B.压缩反应混合物 C.充入N2 D.液化分离NH3
(2)常温下向100m10.2mol/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O物质的量分数与加入盐酸的体积的关系如下图所示,根据图像回答下列问题。

①表示NH3·H2O浓度变化的曲线是______(填“A”或“B")。
②NH3·H2O的电离常数为_______(已知1g1.8=0.26)
③当加入盐酸体积为50ml时,溶液中c(NH4+)-c(NH3·H2O)=____mol/L(用精确值表示)。
II.已知常温下,Ksp[Al(OH)3]=4.0×10-38,在AlCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:________________;若将所得悬浊液的pH调整为3,则溶液中Al3+浓度为_____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com