
A是某工厂废旧机械表面上红色固体的主要成分Fe2O3,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如下图所示:
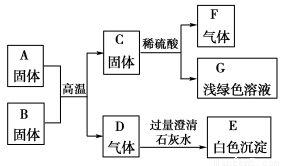
请回答:
(1)写出下列物质的化学式:B________,C________,F________。
(2)写出气体D和过量澄清石灰水反应的离子方程式:__________________________。
(3)写出A和B反应的化学方程式:________________________________________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:选择题
对室温下PH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两溶液的PH均增大
B.使温度都升高20℃(不考虑溶液的挥发)后,两溶液的PH均不变
C.加水稀释2倍后,两溶液的PH均减小
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3盐酸和pH=11的氨水溶液等体积混合
B.pH=3盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3硫酸和pH=11的氨水溶液等体积混合
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组中两种物质在溶液中的反应可用同一离子方程式表示的是
A.Cu(OH)2 + HCl;Cu(OH)2 + CH3COOH
B.NaHCO3 + H2SO4;Na2CO3 + HCl
C.NaHCO3 + NaOH;Ca(HCO3)2 + NaOH
D.BaCl2 + H2SO4;Ba(OH)2 + Na2SO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省、高安二中高二上期中联考化学试卷(解析版) 题型:选择题
下列书写或说法正确的是 ( )
A.聚丙烯的链节是—CH2—CH2—CH2—
B.向苯酚溶液中滴加Na2CO3溶液:
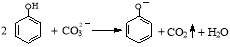
C.2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA
D.苯的同系物能使酸性高锰酸钾溶液褪色,说明烃基对苯环的性质产生了较大的影响
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省简阳市高一上学期第三次月考化学试卷(解析版) 题型:选择题
有两个无标签的试剂瓶,分别盛有Na2CO3、NaHCO3固体,有四位同学为鉴别它们采用了以下不同方法,其中可行的是
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再加入NaOH溶液
C.分别将它们配制成溶液,再进行焰色反应
D.分别加热,再用澄清石灰水检验是否有气体产生
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省简阳市高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.摩尔既是物质的数量单位又是物质的质量单位
B.阿伏加德罗常数是12 kg 12C中含有的碳原子数
C.1 mol H2O分子中含有10 mol电子、
D.一个NO分子的质量是a g,一个NO2分子的质量是b g,则氧原子的摩尔质量是(b-a) g•mol-1
查看答案和解析>>
科目:高中化学 来源:2016届河南省开封市高三上学期第一次模拟理综化学试卷(解析版) 题型:填空题
[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元素 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
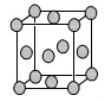
A.O2是 氧化剂
B.HO2 是氧化产物
C. HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源:2016届湖南省十校共同体高三上学期12月联考化学试卷(解析版) 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.该法的工艺流程为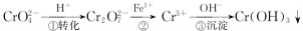
其中第①步存在平衡:2CrO42-(黄色)+2H+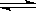 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显____________色.
(2)能说明第①步反应达平衡状态的是________________
a.2v正(Cr2O72-)=v逆(CrO42-)
b.Cr2O72-和CrO42-的浓度相同
c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要_________mol的FeSO4•7H2O,
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至____________
方法2:电解法.
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为__________
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)____________,溶液中同时生成的沉淀还有_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com