
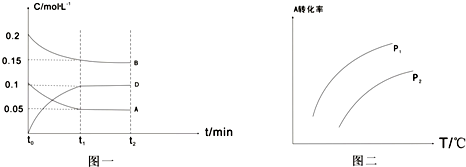
| n |
| V |
| n |
| c(A) |
| 1mol |
| 0.1mol/L |
| 0.5mol |
| 10L |
| △c |
| △t |
| 0.1nol/L-0.05mol/L |
| 5min |


科目:高中化学 来源: 题型:
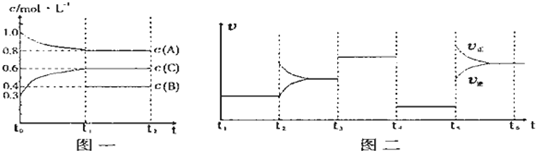
 3C(g)
3C(g) 3C(g)
3C(g)| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol| 2c |
| 3 |
| c |
| 3 |
| 2c |
| 3 |
| c |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol| 2 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
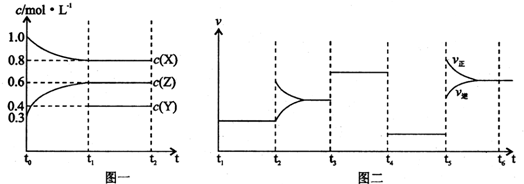
| A、Y的起始物质的量为1.0 mol | ||||
| B、t4-t5阶段改变的条件为减小压强;t5-t6是升高温度 | ||||
| C、此温度下该反应的化学方程式为2X(g)+Y(g)?2Z(g) | ||||
D、在相同条件下,若起始时容器中加入a mol X b mol Y和c mol Z,要达到t1时刻同样的平衡,a,b,c要满足的条件为a+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com