
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:阅读理解

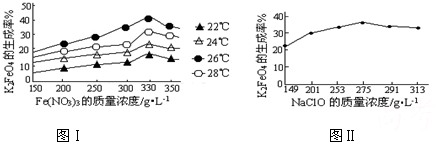
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
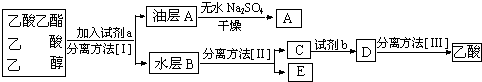
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
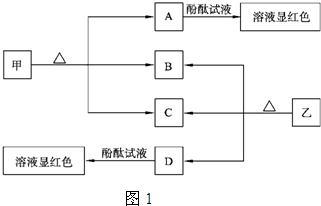
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
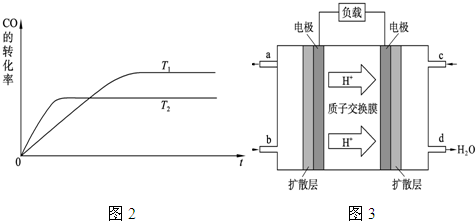
| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:






 的同分异构体很多,其含有-NO2、-CHO、-CH3、
的同分异构体很多,其含有-NO2、-CHO、-CH3、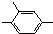 四种基团的同分异构体有多种,其中至少有2个取代基处于苯环对位的同分异构体有6种,它们的结构简式为:
四种基团的同分异构体有多种,其中至少有2个取代基处于苯环对位的同分异构体有6种,它们的结构简式为: 、
、 、
、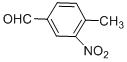 、
、




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验 编号 |
T/K | 反应 时间/h |
反应物的物质的量配比 n[CO(NH2)2]:n[MgCl2?6H2O] |
实验目的 |
| ① | 378 | 3 | 3:1 | (Ⅰ)实验①和③探究 反应物的物质的量配比对产率的影响 反应物的物质的量配比对产率的影响 删除此空 删除此空 ;(Ⅱ)实验②和④探究 温度对产率的影响 温度对产率的影响 ;(Ⅲ)实验②和 ③ ③ 探究反应时间对产率的影响. |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com