
| A. | R的氢化物比Y的氢化物的沸点更高 | |
| B. | X与Z组成的化合物溶于水呈碱性 | |
| C. | 只有Y元素存在同素异形体 | |
| D. | X、Y、Z、R形成简单离子的半径依次增大 |
分析 短周期主族元素X、Y、Z、R的原子序数依次增大,核电荷数之和为36;X、Z原子的最外层电子数之和等于Y原子的次外层电子数;R原子的质子数是Y原子质子数的两倍,由原子序数关系可知X、Z原子的最外层电子数之和应为2,Y的次外层电子数为2,则X为H元素,Z为Na元素,Y为O元素,R为S元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:短周期主族元素X、Y、Z、R的原子序数依次增大,核电荷数之和为36;X、Z原子的最外层电子数之和等于Y原子的次外层电子数;R原子的质子数是Y原子质子数的两倍,由原子序数关系可知X、Z原子的最外层电子数之和应为2,Y的次外层电子数为2,则X为H元素,Z为Na元素,Y为O元素,R为S元素,
A.Y为O元素,对应的氢化物含有氢键,沸点较高,故A错误;
B.X与Z组成的化合物为NaH,与水反应生成氢氧化钠,溶液呈碱性,故B正确;
C.S元素存在同素异形体,如单斜硫等,故C错误;
D.O、Na对应的离子,核电荷数越大离子半径越小,故D错误.
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,A为易错点,注意氢键对熔沸点的影响,试题培养了学生的灵活应用能力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将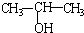 与NaOH的醇溶液共热制备CH3-CH=CH2 与NaOH的醇溶液共热制备CH3-CH=CH2 | |
| B. | 乙酰水杨酸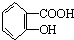 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 | |
| C. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| D. | 苯酚在溴化铁催化作用下与液溴反应生成溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 古文或谚语 | 化学解释 |
| A | 日照香炉生紫烟 | 碘的升华 |
| B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
| C | 煮豆燃豆萁 | 化学能转化为热能 |
| D | 雷雨肥庄稼 | 自然固氮 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [NH4+]>[Cl-]>[OH-]>[H+] | C. | [Cl-]>[NH4+]>[OH-]=[H+] | D. | [Cl-]=[NH4+]>[H+]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2 | |
| B. | 一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA | |
| C. | 常温下18g铝放入足量浓硫酸中转移电子数2NA | |
| D. | 1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入NO2:Na+、Fe2+、Cl-、SO42- | B. | 通入CO2:Na+、K+、NO3-、CO32- | ||
| C. | 通入NH3:CO32-、NH4+、Na+、NO3- | D. | 通入Cl2:K+、NH4+、I-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
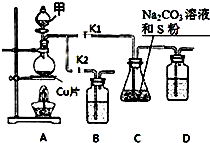 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.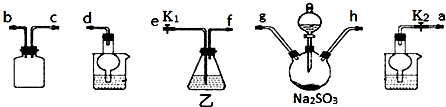
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com