
|
火箭的燃料分为固体燃料和液体燃料等,以铝粉与高氯酸铵的混合物为固体燃料,其中高氯酸铵的反应为:2NH4ClO4 | |
| [ ] | |
A. |
该反应属于分解反应、氧化还原反应 |
B. |
上述反应瞬间能产生大量高温气体,这是推动飞船飞行的主要因素 |
C. |
铝粉的作用是点燃时氧化放热引发高氯酸铵反应 |
D. |
在反应中NH4ClO4仅起到氧化剂作用 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A.该反应属于分解反应、氧化还原反应
B.上述反应瞬间能产生大量高温气体,这是推动飞船飞行的主要因素
C.铝粉的作用是点燃时氧化放热引发高氯酸铵反应
D.在反应中NH4ClO4仅起到氧化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)_______________(填“增大”“减小”或“不变”)。
(3)在
(4)由上述Ksp判断,在上述(3)的体系中,___________(填“能”或“否”)实现AgY向AgZ的转化,简述理由:_______________________________________________________。
(Ⅱ) “嫦娥一号”成功发射,实现了中国人的“奔月”梦想。
(1)发射“嫦娥一号”的长征三号甲火箭的第三级使用的推进剂是液氢和液氧,下列是298 K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:H2(g)+![]() O2(g)
O2(g)![]() H2O(l);ΔH=-285.8 kJ·mol
H2O(l);ΔH=-285.8 kJ·mol![]() CO2(g);ΔH=-393.5 kJ·mol
CO2(g);ΔH=-393.5 kJ·mol![]() O2(g)
O2(g)![]() 8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1 CH4(g)+2O2(g)
8CO2(g)+9H2O(l);ΔH=-5 518 kJ·mol-1 CH4(g)+2O2(g)![]() CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
通过计算说明等质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是_____________,发射“嫦娥一号”的长征三号甲火箭的第三级使用液氢和液氧这种推进剂的优点是__________
__________________________;____________________________________。(请写两条)
(2)已知:H2(g)![]() H2(l);ΔH=-0.92 kJ·mol-1
H2(l);ΔH=-0.92 kJ·mol-1
O2(g)![]() O2(l);ΔH=-6.84 kJ·mol-1
O2(l);ΔH=-6.84 kJ·mol-1
H2O(l)![]() H2O(g);ΔH=44.0 kJ·mol-1
H2O(g);ΔH=44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式______________________________________。
如果此次发射“嫦娥一号”的长征三号甲火箭所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,总共释放能量________kJ(保留3位有效数字)。
(3)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应式为:负极:____________;正极:____________;总反应式:________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三3月摸底考试理综化学试卷(解析版) 题型:填空题
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g) +3H2(g) =CH3OH(g)+H2O(g)? △H1
2CO (g) +O2(g) =2CO2(g)?? △H2
2H2(g)+O2(g) =2H2O(g)??? △H3
则 CO(g) + 2H2(g)  CH3OH(g) 的△H=??????????????? 。
CH3OH(g) 的△H=??????????????? 。
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。

(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数????? (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数????? (结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的 传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
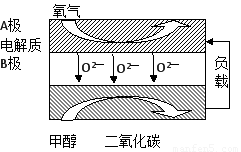
①B极的电极反应式为????????????????????? 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole- 时,实际上消耗的甲醇的质量比理论上大,可能原因是????????????????????? 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀?????? (填“能”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山西省四校高三第四次联考理综化学试卷(解析版) 题型:填空题
甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g) +3H2(g) =CH3OH(g)+H2O(g) ? △H1????
②2CO(g) +O2(g) =2CO2(g)?? △H2
③2H2(g)+O2(g) =2H2O(g)????????? △H3
则CO(g) + 2H2(g)  CH3OH(g) 的△H=??????????????? 。
CH3OH(g) 的△H=??????????????? 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH) 与反应时间t的变化曲线如图所示。该反应的△H???? 0 (填>、<或=)。

(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数???? (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数???? (结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极的电极反应式为????????????????????? 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole- 时,实际上消耗的甲醇的质量比理论上大,可能原因是????????????????????? 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀?????? (填“能”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com