
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而
且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式是 。
(2)方法二中被还原的物质是 ,若反应中产生的ClO2气体在标准状况下的体积为2.24L,则电子转移数为 NA。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:1,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
1)有下列四种微粒:①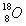 ②
② ③
③ ④
④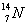 (用序号填空)
(用序号填空)
I.按原子半径由大到小顺序排列是_________________。
II.微粒中质子数小于中子数的是________________。
III.在化合物中呈现的化合价的数值最多的是 ________________。
IV.能形成X2Y2型化合物的是____________,能形成X3Y2型化合物的是____________。
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的离子半径由大到小的顺序是__ ________,原子序数由大到小的顺序是_ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,5.6 L三氧化硫含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)0.5molCH4的质量是________,在标准状况下的体积为________;含________个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为________;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国明代宋应星所著《天工开物》中有关于“升炼倭铅”的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,封裹泥固,······,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,·····,冷定毁罐取出,······,即倭铅也,······,以其似铅而性猛,故名之曰倭”,下列对于这段话中描述的理解错误的是
A、我国历史上铅的使用早于锌 B、锌和铅有相似性但锌更活泼
C、所得产品中混有煤炭 D、属于热还原法冶炼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,,丁与辛属同周期元素,
 (1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(2)用元素符号表示辛、己、戊的原子半径从大到小的顺序 ;
(3)丙与庚的原子核外电子数相差 ;
(4)戊单质电子式为 ,写出一种含戊、己两种元素的离子化合物的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+5O2(g)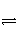
 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com