
在容积均为1 L的甲、乙两个恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B,相同条件下,发生下列反应:A(g)+B(g)xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )

A.甲容器中A的反应速率为0.1 mol·L-1·min-1
B.给甲容器加压可缩短反应达到平衡的时间
C.给乙容器升温可缩短反应达到平衡的时间
D.甲和乙中A的平衡转化率相等
科目:高中化学 来源: 题型:
某小组同学设想用如图装置电解硫酸钾溶液来
制取氧气、氢气、硫酸和氢氧化钾。
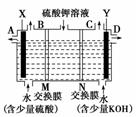
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(选填“A”、“B”、“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为________________________________________________________
________________________________________________________________________。
(4)若在标准状况下,制得11.2 L氢气,则生成硫酸的质量是________,转移的电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g)Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示。下列叙述正确的是( )
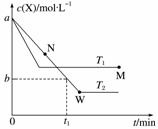
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
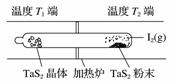
化学反应原理在科研和生产中有广泛应用。利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0(Ⅰ)。如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”、“<”或“=”)。上述反应体系中循环使用的物质是________。
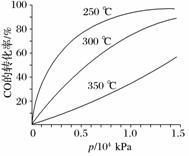
(2)[2011·山东理综,28(3)]CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH______0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生如下反应:2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1,实验测得有关数据如下:
| 容器编号 | 起始时各物质的物质的量 /mol | 达到平衡时体系能量的变化数值 /kJ | ||
| SO2 | O2 | SO3 | ||
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | Q2 |
| 丙 | 0 | 0 | 2 | Q3 |
下列判断中正确的是( )
A.197>Q2>Q1
B.若升高温度,反应的热效应不变
C.Q3=197
D.生成1 mol SO3(l)时放出的热量大于98.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
综合下图判断,下列叙述不正确的是
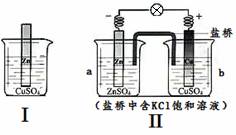
A. Ⅰ、Ⅱ的反应原理均是Zn + Cu2+ = Zn2+ + Cu
B. Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用
C. 随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅
D. 取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
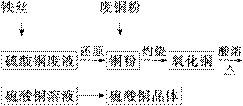 |
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有_____________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是______________
________________________________________________________________________。
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com