
| ||
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池中失去电子的一极一定为负极 |
| B、电解池中与直流电源负极相连的一极一定为阴极 |
| C、电解池中发生氧化反应的一极一定为阳极 |
| D、原电池中负极的质量一定减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O+H2O=2NaOH | ||||
| B、2F2+2H2O=4HF+O2 | ||||
| C、C+H2O=CO+H2 | ||||
D、2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
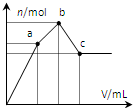 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法正确的( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.下列说法正确的( )| A、a点的溶液呈中性 |
| B、a点沉淀的质量比c点沉淀的质量大 |
| C、b点加入Ba(OH)2溶液的体积为250 mL |
| D、至c点完成反应,反应的离子方程式可表示为:Al3++2SO42-+NH4++2Ba2++5OH-→AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5molCl2与铁反应转移电子数为NA |
| B、在标准状况下,NA个任何分子所占的体积均约为22.4L |
| C、300mL 5mol/L KNO3溶液与300mL 5mol/L KCl溶液含有的离子数均约为3NA |
| D、16gO2和O3中所含的氧原子数均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸溶液中加入氢氧化亚铁:Fe(OH)2+2H+=Fe2++2H2O |
| B、NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| C、FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl- |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
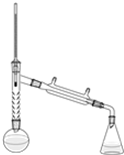 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: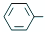 NH2+CHC3OOH?
NH2+CHC3OOH?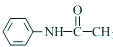 -H2O
-H2O| 名称 | 性状 | 密度/(g/cm3) | 沸点/℃ | 溶解性 | |
| 苯胺 | 无色油状液体,有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙酸 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、相同条件下,结合质子的能力:OH->AlO2->CO32->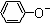 >HCO3->CH3COO- >HCO3->CH3COO- |
B、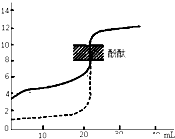 如图表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 |
| D、恒容密闭容器中进行的反应A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com