
【题目】下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
A. Na+、Ba2+、Cl-、SO42-
B. Ca2+、HCO3-、C1-、K+
C. MnO4-、K+、I-、H+
D. H+、Cl-、Na+、CO32-
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下发生如(1)的反应:
(1)请配平方程式,并用双线桥表示得失电子情况:
_____KClO3+______HCl(浓)=______KCl+______ClO2↑+______Cl2↑+______H2O
(2)氧化剂是_________,还原产物是_________(写化学式)。
(3)产生0.1molCl2时,转移电子的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是( )
A. BaCO3能与盐酸反应,可用于治疗胃酸过多
B. MgO熔点高,可用作耐高温材料
C. SO2具有氧化性,可用于漂白品红、织物等
D. NH3极易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中充入2mol SO2和一定量O2。发生反应2SO2+O2![]() 2SO3,当反应进行到4min时,测得n(SO2)=0.4mol。若反应进行到2min时,容器中SO2的物质的量是
2SO3,当反应进行到4min时,测得n(SO2)=0.4mol。若反应进行到2min时,容器中SO2的物质的量是
A.等于1.6 mol B.等于1.2 mol C.大于1.6 mol D.小于1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用环境中细菌对有机质的催化降解能力,科学家开发出了微生物燃料电池,其装置如图所示,a、b为惰性电极。利用该装置可将污水中的有机物(以C6H12O6为例)经氧化而除去,从而达到净化水的目的。下列说法不正确的是( )
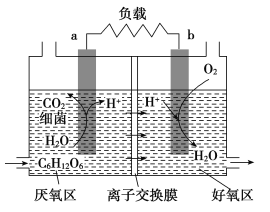
A.a为负极,电极反应式为:C6H12O6+6H2O-24e-=6CO2↑+24H+
B.反应过程中产生的质子透过离子交换膜扩散到好氧区
C.装置中的离子交换膜是阳离子交换膜
D.该装置可把电能转化为生物质能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置制取氯水并进行相关实验。
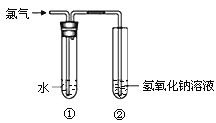
(1)装置②中反应的化学方程式是 ;
(2)取少量装置①中的溶液滴在蓝色石蕊试纸上,试纸先变红后褪色,说明氯水具有的性质是 ;
(3)实验室常用NaOH溶液吸收多余的氯气,下列试剂也可用于吸收氯气的是 (填字母);
a.饱和NaCl溶液 b.蒸馏水 c.Na2SO3溶液
(4)欲验证Cl2的氧化性强于I2,取少量装置①中的溶液加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置,观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
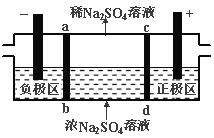
A.通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2 H2O-4e–=O2+4H+,负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图。下列有关说法正确的是( )
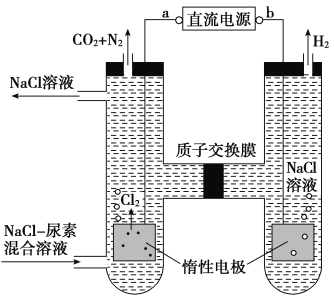
A.a为电源的负极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.阳极室中发生的电极反应为2H++2e-=H2↑
D.若两极共收集到气体13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com