
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
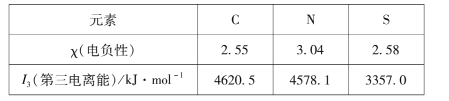
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
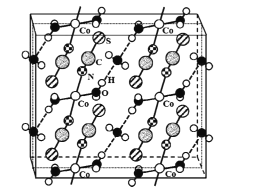
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
【答案】+4 N2+、C2+的价电子排布分别为2s22p1和2s2,C2+的2p轨道全空,处于较稳定状态,更难失去电子 BC [S=C=N]- sp (CN)2和N2均为非极性分子构成的分子晶体,(CN)2的相对分子质量较大,范德华力较大,熔沸点较高 BDE Co(H2O)2(SCN)2·H2O或Co(SCN)2(H2O)2·H2O或Co(SCN)2·3H2O ![]()
【解析】
(1)①硫氰酸根离子中,中心碳原子的电负性比硫和氮都小,所以碳元素显正价,硫、氮元素显负价,由于碳原子最外层只有四个电子,与氮和硫原子结合时,能形成四对共用电子对,故碳显+4价;
②第三电离能用以衡量R2+失去电子的难易程度,N2+、C2+的价电子排布分别为2s22p1和2s2,C2+的2p轨道全空,处于较稳定状态,更难失去电子,所以其第三电离能更大;
(2)K+的3d轨道全空,Zn2+的3d轨道全充满,无法发生d-d跃迁;Fe3+的3d轨道电子排布为3d5,存在5个未成对电子,Ni2+的3d轨道电子排布式为3d8,存在2个未成对电子,二者可以发生d-d跃迁,其硫氰酸盐的水溶液会有颜色,所以选BC;
(3)①从已知结构[S-C≡N]-中碳原子的成键特点(一个叁键、一个单键)可以判断C原子的杂化方式为sp杂化,中心碳原子以两个sp杂化轨道分别和S、N原子的1个p轨道形成σ键,C原子剩余的两个未杂化的2p轨道以肩并肩的方式与氮原子另外2个p轨道形成2个π键,即中心碳原子形成两个σ键和两个π键;另一种可能的情况是,碳原子剩余的两个未杂化的2p轨道分别与氮原子、硫原子的p轨道形成两个大π键,即两个双键的结构[S=C=N]-;
②(CN)2(直线形对称结构,正负电荷中心重合)和N2都是非极性分子,二者均为分子晶体,其熔、沸点高低取决于范德华力的大小,通常相对分子质量越大,范德华力越大;
(4)①从晶胞结构可以看出,硫氰酸钴晶体是一种带有结晶水的配合物,中心原子是Co2+, SCN-和H2O是配体;H2O除了与Co2+形成配位键以外,还有一部分H2O不做配体,只与作为配体的H2O之间以氢键结合;配体H2O、SCN-中都含有极性键,不含非极性键;金属键通常只存在于金属晶体中;所以选BDE;
②根据晶胞结构可知2个Co2+在晶胞内部,4个Co2+在面上,根据均摊法每个晶胞含有的Co2+个数为2+![]() =4;SCN-全在晶胞内,共8个,配体H2O全在晶胞内的有8个(注意与处于上、下底面的Co2+配位的两个H2O分子,均有一个在晶胞内,一个在晶胞外),未做配体的H2O,2个在晶胞内,4个在面上,平均每个晶胞含有这样的水分子个数为4。由此得出Co2+、SCN-、配体H2O、非配体H2O的个数比为1:2:2:1,则化学式为Co(H2O)2(SCN)2·H2O或Co(SCN)2(H2O)2·H2O或Co(SCN)2·3H2O;
=4;SCN-全在晶胞内,共8个,配体H2O全在晶胞内的有8个(注意与处于上、下底面的Co2+配位的两个H2O分子,均有一个在晶胞内,一个在晶胞外),未做配体的H2O,2个在晶胞内,4个在面上,平均每个晶胞含有这样的水分子个数为4。由此得出Co2+、SCN-、配体H2O、非配体H2O的个数比为1:2:2:1,则化学式为Co(H2O)2(SCN)2·H2O或Co(SCN)2(H2O)2·H2O或Co(SCN)2·3H2O;
③由上题分析可知,每个晶胞中含有4个Co(SCN)2·3H2O粒子集合体,每个粒子集合体的质量为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,晶胞的体积为abc×10-21cm3,所以晶胞的密度为
,晶胞的体积为abc×10-21cm3,所以晶胞的密度为![]() g/cm3。
g/cm3。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A. 用系统命名法命名有机物A,名称为2,2,3﹣三甲基戊烷
B. 有机物A的一氯取代物只有4种
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种名称为3,4,4﹣三甲基﹣2﹣戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为:________________________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_________mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN 反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2++ 4 I-= 2CuI↓+ I2
则Cu2+与SCN-反应的离子方程式为________________________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++ NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_______________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因__________________________________。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请从以下提供的实验用品中选择合适的用品,设计实验方案,并画出实验装置图,标明试剂,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。
实验用品:U形管、烧杯、导线、石墨棒若干、铁片若干、盐桥(装有含琼脂的KCl饱和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(![]() )是制备甲硅烷的重要原料。回答下列问题:
)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产![]() 时伴随发生的反应有:
时伴随发生的反应有:
①![]()
②![]()
以硅粉和氯化氢气体生产![]() 的热化学方程式是_______________________。
的热化学方程式是_______________________。
(2)工业上可用四氯化硅和氢化铝锂(![]() )制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
(3)三氯氢硅歧化也可制得甲硅烷。反应![]() 为歧化制甲硅烷过程的关键步骤,此反应采用一定量的
为歧化制甲硅烷过程的关键步骤,此反应采用一定量的![]() 催化剂,在不同反应温度下测得
催化剂,在不同反应温度下测得![]() 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
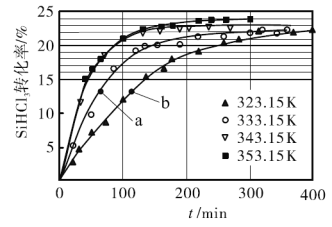
①![]() 时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
②![]() 时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
③比较a、b处反应速率的大小:![]() _______________
_______________![]() (填“>”“<”或“=”)。已知反应速率
(填“>”“<”或“=”)。已知反应速率![]() 分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在
分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在![]() 时
时![]() ___________(保留3位小数)。
___________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是
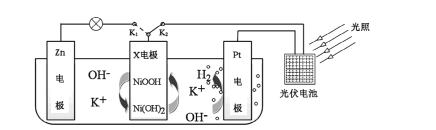
A.制氢时,溶液中K+向Pt电极移动
B.制氢时,X电极反应式为![]()
C.供电时,Zn电极附近溶液的pH降低
D.供电时,装置中的总反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: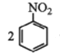 +3Sn+12HCl
+3Sn+12HCl![]()
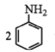 +3SnCl4+4H2O
+3SnCl4+4H2O
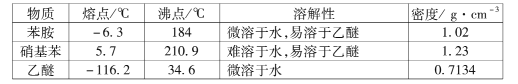
③有关物质的部分物理性质见下表:
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。
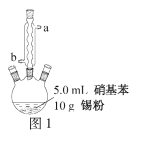
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
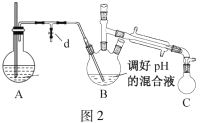
ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni常被镀在金属制品上以保护金属不生锈。
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源___________相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni ++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑![]()
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。______________
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为________________,加热温度不宜过高的原因是________________________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是____________。
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
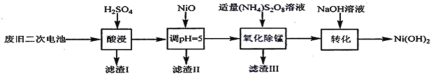
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii._____________________________________(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?____________(列式计算,并使用必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET是目前世界上产量最大的聚酯类合成纤维,冬奥会比赛场馆装饰材料、矿泉水瓶、磁带和胶卷的片基等都广泛采用PET材料。以卤代烃为原料合成PET的线路如下(反应中部分无机反应物及产物已省略)。已知RX2(R、R1代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%。
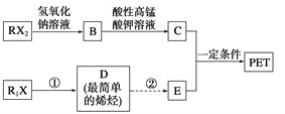
(1)RX2中苯环上有两个取代基,且苯环上的一硝基取代物只有一种。则RX2的结构简式为____________。
(2)1 mol C与足量碳酸氢钠溶液反应可放出________L CO2(标准状况下)。
(3)反应①的化学方程式为______________,其反应类型为________。从D到E,工业上一般通过两步反应来完成。若此处从原子利用率为100%的角度考虑,由D与某种无机物一步合成E,该无机物的化学式为________________。
(4)C的同分异构体M具有:①M分子中,苯环上有三个取代基;②与氯化铁溶液发生显色反应;③与新制氢氧化铜悬浊液在加热条件下反应;④在稀硫酸中能发生水解反应。同时符合上述条件的M的结构有________种。
(5)写出合成PET的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在化学反应中有如图所示的共价键的断裂方式,以下有关乙醇的反应中,其对应价键断裂方式正确的是( )
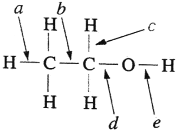
A.Na与乙醇反应时断裂的价键是e
B.在浓硫酸作用下加热到170 ℃时断裂的价键是ae
C.在催化剂作用下和氧气反应时断裂的价键是cd
D.在浓硫酸作用下加热到140 ℃时断裂的价键是be
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com