
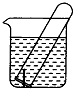
 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察:分析 生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子和水反应生成氢氧根离子,在酸性条件下,铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
解答 解:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,
(1)若试管内液面上升,说明试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,原溶液呈中性,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,
故答案为:吸氧;2H2O+O2+4e-=4OH-;
(2)若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:酸;2H++2e-=H2↑.
点评 本题考查了钢铁的电化学腐蚀,注意酸性条件下,钢铁发生析氢腐蚀,弱酸性或中性条件下,钢铁发生吸氧腐蚀,题目难度不大.


科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
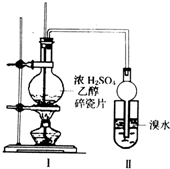 某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的离子结构示意图: | |
| B. | 乙烯的结构简式为:CH2CH2 | |
| C. | 苯分子的结构中没有碳碳单键和碳碳双键,苯分子中的碳碳键是介于它们之间独特的键 | |
| D. | 实验室中用二氧化锰与稀盐酸反应制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可用Cl2制造漂白粉 | B. | MgO 常用作耐高温材料 | ||
| C. | NaCl用于金属钠的冶炼 | D. | Na2CO3是发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2H2O $\frac{\underline{\;通电\;}}{\;}$ 2H2↑+O2↑ | D. | Cl2+2NaOH═NaCl+NaClO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
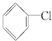 ②
②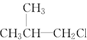 ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤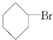 ⑥CH3Cl.
⑥CH3Cl.| A. | ③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
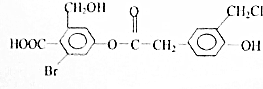 有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )
有机物N的结构如图所示,1mol有机物N在一定条件下分别与足量NaOH(溶液),NaHCO3(溶液),H2反应理论上消耗这3种物质的物质的量之比为( )| A. | 8:1:7 | B. | 5:1:6 | C. | 5:2:6 | D. | 7:1:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com