
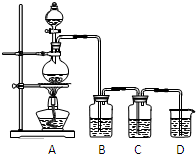
 已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知单质硫是淡黄色粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
| ||
| ||
| ||


科目:高中化学 来源: 题型:
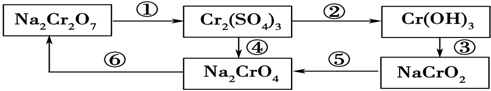
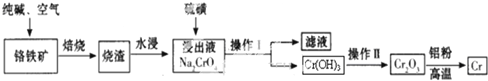
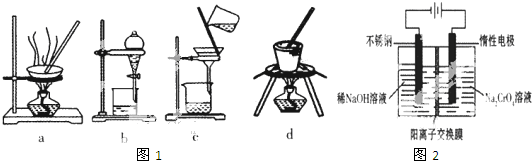
查看答案和解析>>
科目:高中化学 来源: 题型:
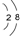
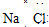
2 1 |
6 3 |
7 3 |
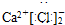
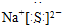
查看答案和解析>>
科目:高中化学 来源: 题型:
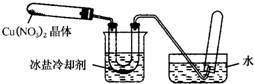 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色, |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | |
| 步骤3: | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q2>Q1=92.4kJ |
| B、Q2=Q1=92.4kJ |
| C、Q2<Q1<92.4kJ |
| D、Q2=Q1<92.4kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
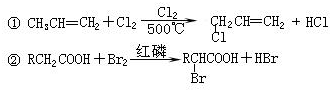
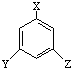 ,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有
,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到的是蓝色沉淀 | ||
B、该溶液中c(S
| ||
| C、向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | ||
| D、向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com