
【题目】下列物质在应用中,只应用其化学性质的是
A. 将活性炭放入冰箱中除去异味B. 用铅笔芯粉末使锁的开启变的更灵活
C. 用二氧化碳灭火D. 用一氧化碳来冶炼生铁
科目:高中化学 来源: 题型:
【题目】已知化合物I的分子式为C11H14O2 , 其合成路线如图所示: 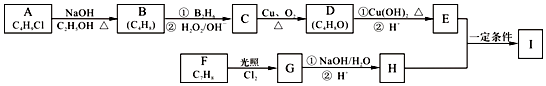
查阅资料有如下信息:
i A的核磁共振氢谱表明其只有一种化学环境的氢;
ii R﹣CH=CH2 ![]() R﹣CH2CH2OH;
R﹣CH2CH2OH;
iii F为苯的同系物.
请回答下列问题:
(1)A的结构简式为 , D所含官能团的名称是 .
(2)C的名称为 , H的分子式为 .
(3)A→B、F→G的反应类型分别为、 .
(4)写出C→D反应的化学方程式: .
(5)I的结构简式为 .
(6)I的同系物J比I的相对分子质量小14,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②能与饱和NaHCO3溶液反应放出CO2 , 共有种(不考虑立体异构).其中核磁共振氢谱为五组峰,且峰面积比为1:2:2:1:6,写出J的这种同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3 , 还含有Fe2O3、FeO、SiO2)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下. 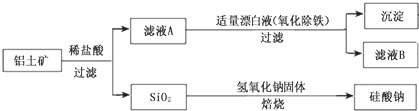
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性.
①该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO﹣+=□Fe(OH)3↓+□C1﹣+
②检验滤液B中是否还含有铁元素的方法为:(注明试剂、现象).
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号).
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、(填操作名称)、洗涤.
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号). 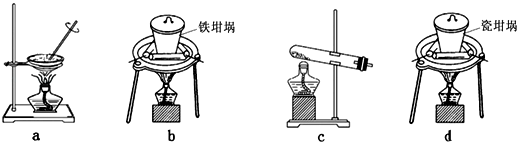
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.lmol/L的NH4Fe(SO4)2溶液中,下列各组离子能大量共存的是( )
A.Ca2+、Mg2+、CH3COO-、SCN-B.K+、Na+、CO32-、OH-
C.Cu2+、Al3+、Cl-、NO3-D.H+、Ba2+、Br-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
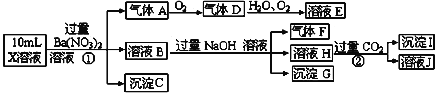
根据以上信息,回答下列问题:
(1)配平①中反应的离子方程式: Fe2+ +H+ +NO3- ===Fe3+ +NO↑+H2O ____
(2)上述离子中,溶液X中除H+外还肯定含有的离子是____,不能确定是否含有的离子是__,若要确定其中阳离子的存在,最可靠的化学方法是____。
(3)沉淀G的化学式为____,写出生成沉淀I的离子方程式____。
(4)假设测定A、F、I均为0.01mol,10ml X溶液中n(H+)=0.04mol,当沉淀C物质的量为0.07mol,能说明(2)中不能确定的阴离子存在的理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF,NO和HNO3 , 请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 .
(2)写出该反应的化学方程式 . 若反应中生成0.2mol HNO3 , 转移的电子数目为个.
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是 .
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF,H2O外,还肯定有(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(所 加试剂均足量). ![]()
下列说法不正确的是( )
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石(Cu2(OH)2CO3),主要燃料是木炭,冶炼温度估计在1000℃左右.
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”.“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜.
(1)关于“曾青”和孔雀石的水溶性分析中,判断正确的是__________
A.前者可溶,后者难溶 B.前者难溶,后者可溶
C.两者均可溶 D.两者均难溶
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有__________
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O
②2CuO+C ![]() 2Cu+CO2↑
2Cu+CO2↑
③CuO+CO ![]() Cu+CO2
Cu+CO2
④CO2+C ![]() 2CO
2CO
A.①② B.①③ C.①②③ D.①②③
(3)在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)__________,不属于氧化还原反应的有__________.
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式 ______________________________________________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com