
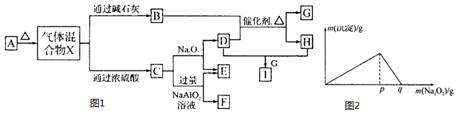
·ÖĪö £Ø1£©Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬Ķ¬Ģå»żĘųĢå¾ßÓŠĻąĶ¬µÄ·Ö×ÓŹż£»½įŗĻ¶žŃõ»ÆĢ¼”¢¼×ĶéµÄ·Ö×Ó¹¹³É¼ĘĖćŌ×Ó×ÜŹżÖ®±Č£»ŅĄ¾Ż¦Ń=$\frac{M}{Vm}$ÅŠ¶ĻĆܶČÖ®±Č£»
£Ø2£©øł¾Żn=$\frac{m}{M}$=$\frac{V}{Vm}$¼ĘĖćĪļÖŹµÄĮæ”¢ÖŹĮ攢Ģå»ż£¬ĄūÓĆN=n”ĮNA¼°ĪļÖŹµÄ¹¹³ÉĄ“¼ĘĖćĪ¢Į£Źż£®
£Ø3£©øł¾Żn=$\frac{V}{Vm}$¼ĘĖć»ģŗĻĘųĢåµÄĪļÖŹµÄĮ棬Įī»ģŗĻĘųĢåÖŠCOŗĶCO2µÄĪļÖŹµÄĮæ·Ö±šĪŖxmol”¢ymol£¬øł¾Ż¶žÕßÖŹĮæÖ®ŗĶÓėĪļÖŹµÄĮæÖ®ŗĶĮŠ·Å³ö¼ĘĖćx”¢yµÄÖµ£¬ŌŁøł¾Żm=nM¼ĘĖćø÷×ŌµÄÖŹĮ棻
ŅĄ¾ŻM=$\frac{m}{n}$¼ĘĖćĘųĢåĘ½¾łÄ¦¶ūÖŹĮ森
½ā“š ½ā£ŗ£Ø1£©Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬Ķ¬Ģå»żĘųĢå¾ßÓŠĻąĶ¬µÄ·Ö×ÓŹż£¬ĖłŅŌŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ£¬Ķ¬Ģå»żµÄ¼×Ķé£ØCH4£©ŗĶ¶žŃõ»ÆĢ¼·Ö×ÓŹżÖ®±Č1£ŗ1£»Ō×ÓøöŹżÖ®±ČĪŖ£ŗ1”Į5£ŗ1”Į3=5£ŗ3£»ŅĄ¾Ż¦Ń=$\frac{M}{Vm}$ÅŠ¶ĻĆܶČÖ®±Č£¬æÉÖŖŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ£¬Ķ¬Ģå»żµÄ¼×Ķé£ØCH4£©ŗĶ¶žŃõ»ÆĢ¼ĆܶČÖ®±ČĪŖ£ŗ16£ŗ44=4£ŗ11£»
¹Ź“š°øĪŖ£ŗ1£ŗ1£»5£ŗ3£»4£ŗ11£»
£Ø2£©£ŗ¢ŁĒāĘųµÄĪļÖŹµÄĮæĪŖ$\frac{4g}{2g/mol}$=2mol£¬Ęä·Ö×ÓŹżĪŖ2NA£¬Ō×ÓŹżĪŖ4NA£¬ÖŹĮæĪŖ4g£¬±ź×¼×“æöĻĀµÄĢå»żĪŖ2mol”Į22.4L/mol=44.8L£»
¢ŚŃõĘųµÄĪļÖŹµÄĮæĪŖ$\frac{11.2L}{22.4L/mol}$=0.5mol£¬Ęä·Ö×ÓŹżĪŖ0.5NA£¬Ō×ÓŹżĪŖNA£¬ÖŹĮæĪŖ0.5mol”Į32g/mol=16g£¬±ź×¼×“æöĻĀµÄĢå»żĪŖ11.2L£»
¢ŪĖ®µÄĪļÖŹµÄĮæĪŖ1mol£¬Ęä·Ö×ÓŹżĪŖNA£¬Ō×ÓŹżĪŖ3NA£¬ÖŹĮæĪŖ1mol”Į18g/mol=18g£¬±ź×¼×“æöĻĀĖ®ĪŖŅŗĢ壬ĘäĢå»żŌŚČżÕßÖŠ×īŠ”£»
ĻŌČ»·Ö×ÓŹż×ī¶ąµÄŹĒ¢Ł£¬ÖŹĮæ×ī“óµÄŹĒ¢Ū£¬Ģå»ż×īŠ”µÄŹĒ¢Ū£¬
¹Ź“š°øĪŖ£ŗ¢Ł£»¢Ū£»¢Ū£®
£Ø3£©»ģŗĻĘųĢåµÄĪļÖŹµÄĮæn=$\frac{22.4L}{22.4L/mol}$=1mol£»
Įī»ģŗĻĘųĢåÖŠCOŗĶCO2µÄĪļÖŹµÄĮæ·Ö±šĪŖxmol”¢ymol£¬Ōņ£ŗx+y=1£¬28x+44y=40£¬½āµĆy=0.75£¬x=0.25£¬
Ōņm£ØCO£©=0.25mol”Į28g/mol=7g£¬m£ØCO2£©=0.75mol”Į44g/mol=33g£¬ĖłŅŌ¶žÕßÖŹĮæÖ®±ČĪŖ£ŗ7£ŗ33£»
»ģŗĻĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæŹĒ£ŗM=$\frac{40g}{1mol}$=40g/mol£»
¹Ź“š°øĪŖ£ŗ7£ŗ33£»40g/mol£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄĮæÓŠ¹Ų¼ĘĖć£¬»ģŗĻĪļµÄÓŠ¹Ų¼ĘĖć”¢³£ÓĆ»Æѧ¼ĘĮæµÄÓŠ¹Ų¼ĘĖć£¬±Č½Ļ»ł“”£¬ŹģĻ¤ŅŌĪļÖŹµÄĮæĪŖŗĖŠÄ¼ĘĖć¹«Ź½ŹĒ½āĢā¹Ų¼ü£¬×¢Ņā¶Ō¹«Ź½µÄĄķ½āÓėĮé»īŌĖÓĆ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| IČÜŅŗµÄĢå»ż£ØmL£© | 4 | 8 | 15 | 20 | 50 | 120 | 150 |
| CµÄĢå»ż£ØmL£© | 0 | 0 | 112 | 224 | 896 | 2240 | 2240 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
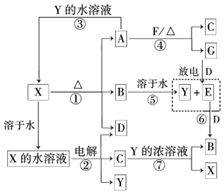 A”«G¼°X”¢Y¾łŹĒ֊ѧ»Æѧ³£¼ūĪļÖŹ£¬ĘäÖŠB”¢D”¢E”¢F”¢GŌŚ³£ĪĀĻĀĪŖĘųĢåĒŅBĪŖŗģ×ŲÉ«£¬CµÄĮņĖįŃĪČÜŅŗĶس£ĪŖĄ¶É«£¬ĖüĆĒÖ®¼äÓŠČēĻĀ×Ŗ»Æ¹ŲĻµ£ØĘäÖŠ·“Ó¦¢Ū¢Ü¢ßµÄ²śĪļÖŠµÄĖ®ŅŃĀŌČ„£©£®
A”«G¼°X”¢Y¾łŹĒ֊ѧ»Æѧ³£¼ūĪļÖŹ£¬ĘäÖŠB”¢D”¢E”¢F”¢GŌŚ³£ĪĀĻĀĪŖĘųĢåĒŅBĪŖŗģ×ŲÉ«£¬CµÄĮņĖįŃĪČÜŅŗĶس£ĪŖĄ¶É«£¬ĖüĆĒÖ®¼äÓŠČēĻĀ×Ŗ»Æ¹ŲĻµ£ØĘäÖŠ·“Ó¦¢Ū¢Ü¢ßµÄ²śĪļÖŠµÄĖ®ŅŃĀŌČ„£©£®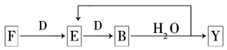
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | MgSO4ČÜŅŗÓėBa£ØOH£©2ČÜŅŗ·“Ó¦£ŗSO42-+Ba2+ØTBaSO4”ż | |
| B£® | Ļņ³ĪĒåµÄŹÆ»ŅĖ®ÖŠ¼ÓČė¹żĮæNaHCO3ČÜŅŗ£ŗHCO3-+Ca2++OH-ØTCaCO3”ż+H2O | |
| C£® | ĻņAl2£ØSO4£©3ČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®ČÜŅŗ£ŗAl3++3NH3•H2OØTAl£ØOH£©3”ż+3NH4+ | |
| D£® | ĻņCa£ØClO£©2ČÜŅŗÖŠĶØČėSO2£ŗCa2++2ClO-+SO2+H2OØTCaSO3”ż+2HClO |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ĄÖ¹“߻ƼĮÖŠ¶¾ | B£® | Ģįøß·“Ó¦Š§ĀŹ | C£® | ĢįøßSO2×Ŗ»ÆĀŹ | D£® | ·ĄÖ¹»·¾³ĪŪČ¾ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ü¢Ż | B£® | ¢Ū¢Ü¢Ž | C£® | ¢Ū¢Ü¢Ż | D£® | ¢Ł¢Ū¢Ü¢Ż¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com