
| A、组成NH5的元素都是非金属,属于共价化合物 |
| B、NH5中氢元素为+1价 |
| C、NH5与水的反应是氧化还原反应 |
| D、NH5溶于水后溶液呈碱性 |


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、H2O2、H+、Fe3+、Cl- |
| B、Cl2、OH-、K+、NH4+ |
| C、H+、CH3CH2OH、SO42-、MnO4- |
| D、Ba2+、NO3-、Na+、NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn+H2SO4═ZnSO4+H2↑ | ||||
B、2KMnO4
| ||||
| C、CaO+H2O═Ca(OH)2 | ||||
D、H2+Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cu2S参加反应时有8 mol电子转移 |
| B、参加反应的n(Cu2S):n(HNO3)=1:5 |
| C、反应中Cu2S既做氧化剂,又做还原剂 |
| D、产物n[Cu(NO3)2]:n[CuSO4]=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是
(1)把除去氧化膜的铁丝投入到盛有稀硫酸的试管中,产生氢气的速率变化情况如图所示图中t1~t2速率变化的主要原因是查看答案和解析>>
科目:高中化学 来源: 题型:
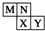 M、N、X、Y四种短周期主族元素在元素周期表中的相对位置如图所示.已知它们的原子序数总和为48,则下列有关说法中不正确的是( )
M、N、X、Y四种短周期主族元素在元素周期表中的相对位置如图所示.已知它们的原子序数总和为48,则下列有关说法中不正确的是( )| A、N与X位于元素周期表中ⅥA族 |
| B、M、X、Y三种元素的最高价氧化物对应的水化物均为强酸 |
| C、M、N、X、Y均位于金属与非金属的分界线上 |
| D、M的气态氢化物与Y的气态氢化物反应,可生成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com