
| A. | 质量为17 g | |
| B. | 含有6.02×1023个NH3分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1 L水后,液中NH4+的浓度为2 mol.L-1 |
分析 A、根据质量m=nM来计算;
B、根据分子个数N=nNA来计算;
C、根据体积V=nVm来计算;
D、溶液的体积≠溶剂的体积,且氨气与水的反应为可逆反应、一水合氨的电离不完全.
解答 解:A、2mol氨气的质量m=nM=2mol×17g/mol=34g,故A错误;
B、2mol氨气中的分子个数N=nNA=2mol×NA/mol=2NA=1.204×1024个,故B错误;
C、2mol氨气在标况下的体积V=nVm=2mol×22.4L/mol=44.8L,故C正确;
D、溶液的体积≠溶剂的体积,故溶液的体积大于1L,且氨气与水的反应为可逆反应、一水合氨为弱碱,只能部分电离,故溶液中的铵根离子的浓度小于2mol/L,故D错误.
故选C.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及气体存在的条件,难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:解答题
 某混合溶液中可能含有的离子如表所示:
某混合溶液中可能含有的离子如表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n (Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n (Br-) | 3.0mol | 2.6mol | 1.6mol |
| n (I-) | x mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g | B. | 0.32g | C. | 3.2g | D. | 6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电池.甲醇燃料电池的工作原理如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
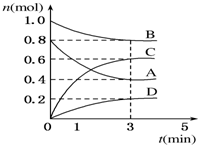 T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.
T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、300 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{500℃、300MPa}^{催化剂}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:A12O3+2OH-═2AlO${\;}_{2}^{-}$+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com