
| A. | 强电解质溶液的导电能力一定比弱电解质强 | |
| B. | 冰醋酸是弱电解质,但液态时不能导电 | |
| C. | 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
分析 A.溶液的导电能力与离子浓度成正比;
B.醋酸在溶液中部分电离,液态时不发生电离;
C.盐酸中加入固体NaCl,溶液中氢离子浓度不变;
D.硫酸钡在溶液中完全电离.
解答 解:A.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,溶液的导电能力与离子浓度成正比,故A错误;
B.醋酸在溶液中部分电离,属于弱电解质,在液态时不发生电离,所以液态时不能导电,故B正确;
C.盐酸中加入固体NaCl,溶液中氯离子浓度增大,由于HCl在溶液中完全电离,所以溶液中氢离子浓度不变,故C错误;
D.电解质的强弱与电解质的溶解性无关,硫酸钡在溶液中完全电离属于强电解质,故D错误.
故选B.
点评 本题考查了强弱电解质的判断,注意强电解质溶液的导电能力不一定强,导电能力强的溶液不一定是强电解质溶液,为易错点,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->IO3->Cl2 | B. | ClO3->BrO3->Cl2>IO3- | ||
| C. | BrO3->ClO3->Cl2>IO3- | D. | Cl2>BrO3->ClO3->IO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 编 号 | ① | ② | ③ | ④ | ⑤ | |
试剂 用量 (mL) | 0.20mol•L-1(NH4)2 S2O8溶液 | 20.0 | 10.0 | b | 20.0 | 20.0 |
| 0.20mol•L-1KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010mol•L-1 Na2S2O3溶液 | a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20mol•L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | c | |
| 0.20mol•L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20℃时,反应时间△t(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在空气中燃烧 | B. | 金属钠与水反应 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 焦炭在高温下与水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH的电离程度增大,c(H+)增大 | |
| B. | 平衡向生成CH3COOH移动,c(H+)减小 | |
| C. | CH3COOH电离程度减小,pH减小 | |
| D. | 电离平衡向生成CH3COO-、H+方向移动,pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
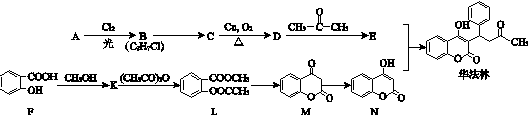
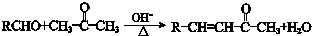
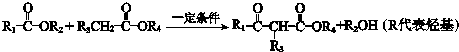
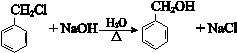 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A到F是原子序数依次增大的前四周期元素:
A到F是原子序数依次增大的前四周期元素:| A | A是原子半径最小的元素 |
| B | B基态原子的价层电子排布式为nsnnpn |
| D | D原子最外层电子数是次外层电子数的三倍 |
| E | C的三价阴离子和E的二价阳离子具有相同的电子层结构 |
| F | F元素的基态原子有六个成单电子 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取氢氧化钠固体的质量/g | 应选用容量瓶的规格/mL | 除烧杯、托盘天平、容量瓶、量筒外还需的其它仪器 |
| 10.0 | 250 | 玻璃棒、胶头滴管、药匙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com