
下列说法正确的是

A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体
B.图Ⅱ装置可验证非金属性:Cl>C>Si
C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3
D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化
C
【解析】
试题分析:A、浓硫酸与Cu反应制取二氧化硫气体需要加热,错误;B、盐酸易挥发,所以产生的二氧化碳气体中含有HCl,不能证明与硅酸钠反应产生的白色沉淀是二氧化碳与硅酸钠溶液反应所致,同时盐酸的酸性与碳酸酸性的强弱不能作为判断非金属性强弱的依据,错误;C、图III装置收集氢气和氨气时,因为气体的密度小于空气,所以用向下排空气法,气体从右端进入;若收集二氧化碳、氯气密度大于空气的气体,则从左端进入,正确;D、二氧化硫通入溴水中,恰好完全反应时,生成硫酸和氢溴酸两种强酸,溶液的pH减小,继续通入二氧化硫气体,则二氧化硫与水反应生成的亚硫酸为弱酸,所以溶液的pH又增大,错误,答案选C。
考点:考查对实验的评价,图像的分析


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,W、X的最外层电子数之比为4︰3,Y原子的最外层电子数是次外层电子数的一半,Z元素原子的半径在同周期元素原子中最小。下列叙述正确的是
A.W、X、Y的最高价氧化物都能与NaOH溶液反应,它们都属于酸性氧化物
B.W、Y、Z三种元素简单气态氢化物的热稳定性为: Z>W>Y
C.Z元素最高价氧化物对应的水化物的化学式为HZO3
D.原子半径的大小顺序为:rY>rW>rX
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大。金属W是制备手机电池的常用材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最高的金属元素,Z原子的最外层电子数是它的电子层数的2倍。下列说法正确的是
A.W的金属性是同主族元素中最强的
B.X、Z形成的化合物为离子化合物
C.X最高价氧化物对应水化物的酸性大于Z的最高价氧化物对应水化物的酸性
D.原子半径Y>Z,离子半径Y3+< Z 2-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol溴苯中含有双键的数目为0.3NA
B.0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA
C.5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA
D.标准状况下,11.2L 由H2和CO组成的混合气体中含有分子的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了 ,B元素位于周期表五个区域中的 区。

②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②六氰合亚铁离子[Fe(CN)6]4—中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
③写出一种与 CN—互为等电子体的单质分子式 。
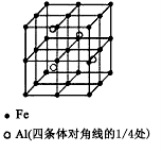
(3)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
分子式为C3H2Cl6的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去的离子有______、_______。
②盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③过程VI中,产品NaOH在电解槽的______区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列有关物质的制备和转化正确的是
A.常温下,用铝与浓硫酸反应制备二氧化硫
B.氯化钡溶液中通入二氧化硫可生成BaSO3沉淀
C.用FeS除去废水中的重金属铜离子
D.以粗铜作阴极,硫酸铜溶液为电解质溶液电解精炼铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com