
| A. | 0.1mol | B. | 0.4mol | C. | 1.1mol | D. | 1.6mol |
分析 0.4molCH4与Cl2发生取代反应,欲得到四种取代物的物质的量相等,则生成CH3Cl、CH2Cl2、CHCl3、CCl4各为0.1mol,恢复到室温时,该容器内的气体为HCl、CH3Cl,以此来解答.
解答 解:由于氯气发生的取代反应是1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成氯化氢,所以参加反应的氯气的物质的量等于生成的氯代烃中氯原子的物质的量,而4种氯代烃的物质的量相等,即0.4molCH4与Cl2发生取代反应,欲得到四种取代物的物质的量相等,则生成CH3Cl、CH2Cl2、CHCl3、CCl4各为0.1mol,所以所需的氯气的物质的量为0.1mol×(1+2+3+4)=1mol,同时生成HCl为1mol,恢复到室温时,该容器内的气体为HCl、CH3Cl,可知气体的物质的量为1mol+0.1mol=1.1mol,故选C.
点评 本题以甲烷和氯气的取代反应考查计算,题目难度不大,注意把握氯气与甲烷发生取代反应的特征及生成物在常温下的状态.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙烷都能在空气中燃烧而被氧气氧化,具有强还原性,所以它们也能被强氧化剂高锰酸钾氧化 | |
| B. | 苯和乙烯都易发生加成反应,乙烷能发生取代反应 | |
| C. | 将苯与浓硝酸混合共热可制得硝基苯,属加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的键完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
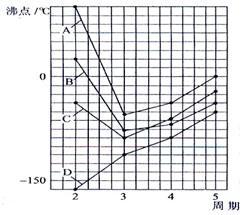 如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.
如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B的结构简式
,B的结构简式 或
或 .
. ,
, 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
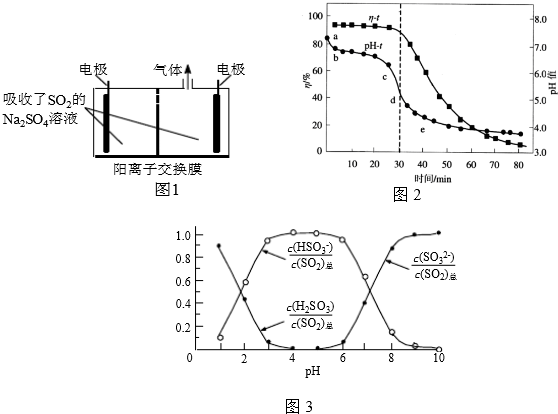
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.25 mol•L-1•min-1 | D. | v(FeSO4)=0.25 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
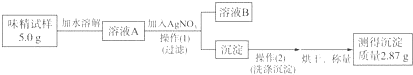
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com