
| A、钢铁的腐蚀过程绝大多数都是电化学腐蚀 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、电解CuCl2饱和溶液,生成金属铜和氯气 |
| D、电解MgCl2饱和溶液,可制得金属镁 |


科目:高中化学 来源: 题型:
| V |
| 4 |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是一种物理量 |
| B、1 mol CO2的质量是44 g/mol |
| C、标准状况下的气体摩尔体积约占22.4 L |
| D、某条件下,单位物质的量的气体所占的体积就是该条件下的气体摩尔体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
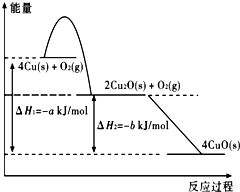 铜及其化合物在工业、农业、科技和日常生活中有广泛应用.
铜及其化合物在工业、农业、科技和日常生活中有广泛应用.| 已生锈的金属质量 |
| 金属的总质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、降温,化学平衡向逆反应方向移动 |
| B、使用催化剂可使D%有所增加 |
| C、化学方程式中气体的化学计量数m<p+q? |
| D、B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 正极 | Fe | Cu | Cu | C |
| 负极 | Cu | C | Fe | Cu |
| 电解质溶液 | Fe2(SO4)3 | Fe2(SO4)3 | CuSO4 | Fe2(SO4)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com