
分析 (1)根据14.51克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水,可知BaCO3和BaSO4的质量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,以此分别计算以此计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度,以及产生的气体在标准状况下的体积;
(2)根据方程式BaCO3+2HNO3══Ba(NO3)2+CO2↑+H2O并由(1)中BaCO3的物质的量求得消耗HNO3的物质的量,根据题意求出硝酸的种物质的量,两者相减既得剩余硝酸的物质的量,并根据n=cv,求H+的浓度并求pH.
解答 解:(1)碳酸钡能够溶于稀硝酸,硫酸钡不溶,依据质量守恒得:n(Na2SO4)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,所以硫酸钠的物质的量浓度为:c(Na2SO4)=$\frac{0.02mol}{0.5L}$=0.04mol/L;
碳酸钡的质量为:14.51g-4.66g=9.85g,碳酸钡的物质的量为n(BaCO3)=$\frac{9.85g}{197g/mol}$=0.05mol,根据质量守恒可知:n(Na2CO3)=n(BaCO3)=0.05mol,则碳酸钠的物质的量浓度为:c(Na2CO3)=$\frac{0.05mol}{0.5L}$=0.1mol/L,
答:原混合溶液中NaCO3和Na2SO4的物质的量浓度分别为0.04mol/L、0.1mol/L.
(2)设反应消耗硝酸的物质的量为xmol.
BaCO3+2HNO3══Ba(NO3)2+CO2↑+H2O
1mol 2mol
0.05mol xmol
$\frac{1mol}{0.05mol}$=$\frac{2mol}{xmol}$,x=0.1mol
即n(消耗HNO3)=0.1mol
∵n(原HNO3)=0.1L×2mol=0.2mol
∴n(剩HNO3)=n(原HNO3)-n(消耗HNO3)=0.2mol-0.1mol=0.1mol
c(剩HNO3)=c(H+)=$\frac{n(消耗HNO3)}{V}$=$\frac{0.1mol}{0.1L}$=1mol
pH=-lgc(H+)=-lg1=0
答:稀释后溶液的pH为0
点评 本题考查了有关方程式的计算,明确反应的实质是解题关键,注意碳酸钡和硫酸钡的性质,并且由剩余硝酸的浓度来求溶液的pH,本题目难度不大.声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布.题目难度不大.


科目:高中化学 来源: 题型:选择题
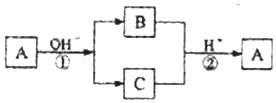
| A. | X元素可能为Al | B. | X元素可能为金属,也可能为非金属 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②一定为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 2 mol•L-1的NaCl | B. | 75 mL 2 mol•L-1的NH4Cl | ||
| C. | 150 mL 3 mol•L-1的KCl | D. | 75 mL 2 mol•L-1的CaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶未干燥 | |
| B. | 定容时俯视液面 | |
| C. | 转移时有液体溅出 | |
| D. | 颠倒摇匀后发现液面低于刻度线,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
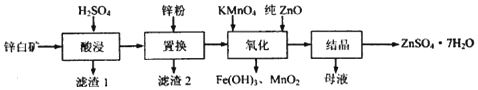
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com