
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性。把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅。一定条件下,在20L恒容密闭容器中发生SiCl4转化为SiHCl3 的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
4SiHCl3(g) ΔH=Q kJ·mol-1。2 min后达到平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1。
(1)从反应开始到平衡,v(SiCl4)= 。
(2)该反应的平衡常数表达式为K= ,温度升高,K值增大,则Q 0(填“>”、“<”或“=”)。
 (3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(3)若平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”)。
(4)原容器中,通入H2的体积(标准状况下)为 。
(5)平衡后,将容器的体积缩为10 L,再次达到平衡时,
H2的物质的量浓度范围为 。
【知识点】化学反应速率、化学平衡的移动 G1 G2 G5
【答案解析】
(1)0.075 mol·L-1·min-1 (2)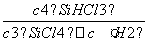 ;> (3)减小 (4)89.6 L
;> (3)减小 (4)89.6 L
(5)0.1 mol·L-1<c(H2)<0.2 mol·L-1
解析:(1)根据同一反应的同一速率,速率比等于方程式的系数比:v(SiCl4)=3/4v(SiCl3)=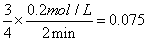 mol·L-1·min-1
mol·L-1·min-1
(2)利用平衡常数的定义写出,注意反应物中硅为固体。温度升高,K值增大,说明平衡正向移动,正方向是吸热的,Q>0。
(3)平衡后再向容器中充入与起始时等量的SiCl4和H2(假设Si足量),相当于加压,由于加压平衡正向移动,所以当反应再次达到平衡时,与原平衡相比较,H2的体积分数将减小。
(4)平衡,H2与SiHCl3的物质的量浓度分别为0.1 mol·L-1和0.2 mol·L-1,根据方程式知氢气的浓度减小了0.2 mol·L-1÷2=0.1 mol·L-1,所以开始氢气的浓度为0.1mol·L-1+0.1mol·L-1=0.2mol·L-1,原容器中,通入H2的体积(标准状况下)为:0.2mol·L-1×20L×22.4L/mol=89.6 L
平衡后,将容器的体积缩为10 L,再次达到平衡时,
(5)平衡后,将容器的体积缩为10 L,假设平衡不移动c(H2)=0.2 mol·L-1,但由于加压平衡右移c(H2)<0.2 mol·L-1,根据勒夏特列原理c(H2)>0.1mol·L-1
所以H2的物质的量浓度范围为0.1 mol·L-1<c(H2)<0.2 mol·L-1
【思路点拨】本题考查化学反应速率、化学平衡的移动,计算式要认真,关键是理解平衡移动原理。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)  MgO(s)
MgO(s)
+ CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x |
|
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与C |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2 • 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如右图,则下列叙述正确的是
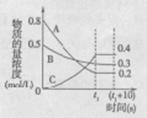
A.该反应的化学方程式为A+3B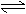
 2C
2C
B.在tl s时,v(A)正=0
C.(t1+l0)s时再充入0.4 molA和0.25 mol B,反应物A的转化率增大
D.若该反应在绝热容器中进行,也在tl时刻达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2===2NO,经测定前3 s用N2表示的反应速率为0.1 mol·L-1·s-1,则6 s末NO的浓度为
A.1.2 mol·L-1 B.大于1.2 mol·L-1
C.小于1.2 mol·L-1 D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏伽德罗常数,下列叙述错误的是
A.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA
B.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子
C.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA
D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且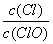 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A、若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=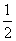
B、参加反应的氯气的物质的量等于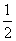 amol
amol
C、改变温度,反应中转移电子的物质的量n的范围: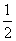 amol≤n≤
amol≤n≤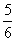 amol
amol
D、改变温度,产物中KC1O3的最大理论产量为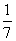 amol
amol
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的数值,下列叙述正确的是
A.常温下,1mol丙烯中含碳原子数为3NA
B.常温下,pH=13的 NaOH溶液中含OH-数为NA
C.标准状况下,22.4LCHCl3中含C-H键数为NA
D.23g Na与足量氧气反应时转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法不正确的是 ( )
A.化学反应达到最大限度时,正逆反应速率也达到最大且相等
B.催化剂能降低化学反应的活化能,加快反应速率,提高生产效率
C.用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率
D.用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com