
| A、2:3 | B、1:4 |
| C、4:1 | D、3:2 |
| 2.0 |
| 1.0 |
| 2.2×2 |
| 1.0 |

| x+4y |
| x+y |
| 4×2+8 |
| 2+1 |
| 16 |
| 3 |
| 6x+4y |
| x+y |


科目:高中化学 来源: 题型:
| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是氧化还原反应,Na2O2是氧化剂,CO2是还原剂 |
| B、是氧化还原反应,CO2是氧化剂,Na2O2是还原剂 |
| C、不是氧化还原反应,是碱性氧化和酸性氧化物反应 |
| D、是氧化还原反应,Na2O2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | L层上有2对未成对电子 |
| X | 最外层电子数是次外层电子数的3倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
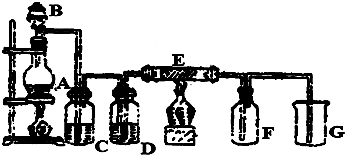
查看答案和解析>>
科目:高中化学 来源: 题型:
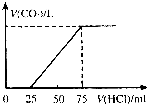 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
 | p1(Mpa) | p2(Mpa) |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
A、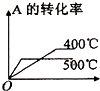 |
B、 |
C、 |
D、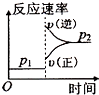 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用滤纸称量NaOH固体 |
| B、容量瓶中原来存在少量蒸馏水 |
| C、溶解后的烧杯未经洗涤 |
| D、定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O |
| B、已知ⅣA沸点CH4<SiH4<GeH4,则ⅤA族沸点 NH3<PH3<AsH3 |
| C、已知Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S |
| D、已知Ca(HCO3)2+2NaOH(过量)=CaCO3↓+Na2CO3+2H2O,则Mg(HCO3)2+2NaOH(过量)=MgCO3↓+Na2CO3+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com