
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )
A.1∶2B.1∶4C.3∶4D.3∶2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2 , 他们使用的药品和装置如下图所示:
(1)SO2气体还原Fe3+生成的还原产物是(填离子符号),参加反应的SO2 和Fe3+的物质的量之比是 .
(2)下列实验方案适用于在实验室制取所需SO2的是(双选,填序号).
A.Na2SO3溶液与HNO3
B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧
D.铜与热浓H2SO4
(3)装置C的作用是 .
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(双选,填序号).A蒸发皿 B 石棉网 C 漏斗 D 烧杯 E 玻璃棒 F 坩埚
(5)在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第三份试液加入用稀盐酸酸化的BaCl2 , 产生白色沉淀.
上述方案不合理的一个是 , 原因是 .
(6)上述装置中能表明I﹣的还原性弱于SO2的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示装置(部分仪器已略去)回答下列有关问题。
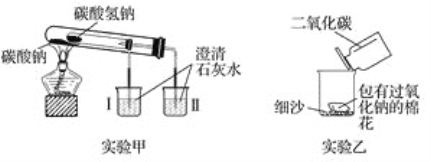
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”),该烧杯中发生反应的化学方程式是____________________________________,通过实验甲可证明_____________(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来探究Na2O2与CO2的反应,观察到的实验现象为包有Na2O2的棉花着火。写出Na2O2与CO2反应的化学方程式:______________________________,棉花着火说明该反应的特点是____________________________。
(3)取10 g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石水中,测得生成沉淀的质量为4.0 g。则原混合物中碳酸钠的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见物质间的转化关系.其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1mol E中含有 10mol电子.乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色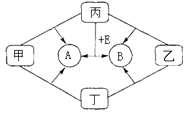
(1)写出化学式:甲;乙;丙;
(2)丁的摩尔质量为 .
(3)写出丙和E反应生成A和B的化学方程式:
(4)有学生将乙和丁混和加热后收集到标准状况下气体8.96L,测得该气体对氢气的相对密度为16,若将气体通入足量的澄清石灰水中,得到白色沉淀物g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A.热稳定性:Na2CO3比NaHCO3稳定
B.溶解性:Na2CO3比NaHCO3易溶于水
C.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出CO2多
D.相同物质的量浓度的Na2CO3和NaHCO3溶液分别与同浓度的盐酸反应,产生气体的速率是Na2CO3大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,滴入水中出现分层现象,滴入热的氢氧化钠溶液中分层现象不会逐渐消失的是(不考虑有机物的挥发)( )
A.溴乙烷B.乙醛C.橄榄油D.汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列氧化还原反应,并用双线桥法标出电子转移的数目和方向,并指出氧化剂和还原剂。
(1)2H2S + SO2 = 3S + 2H2O (2)2Mg + CO2 ![]() 2MgO + C
2MgO + C
_________________、_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com