
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是
A.Na2CO3溶液显碱性:![]() +2H2O
+2H2O![]() H2CO3+2OH
H2CO3+2OH
B.HS电离的离子方程式:HS+H2O![]() H3O++S2
H3O++S2
C.少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++![]() +2OH
+2OH![]() CaCO3↓+2H2O+
CaCO3↓+2H2O+![]()
D.在0.5 mol·L1的K2Cr2O7溶液中存在如下平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+,其平衡常数的表达式为
+2H+,其平衡常数的表达式为![]()
【答案】A
【解析】
A. CO32-水解使溶液显碱性;
B. HS电离生成H+和S2-;
C. 少量氢氧化钙溶液与碳酸氢钠溶液反应生成碳酸钙、碳酸钠和水;
D. 平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值。
A. CO32-水解使溶液显碱性,离子方程式为:![]() +H2O
+H2O![]() HCO3-+OH,A项错误,符合题意;
HCO3-+OH,A项错误,符合题意;
B. HS电离生成H+和S2-,电离方程式为:HS+H2O![]() H3O++S2,简化为HS
H3O++S2,简化为HS ![]() H++S2,B项正确,不符合题意;
H++S2,B项正确,不符合题意;
C. 少量氢氧化钙溶液与碳酸氢钠溶液反应生成碳酸钙、碳酸钠和水,反应的离子方程式:Ca2++![]() +2OH
+2OH![]() CaCO3↓+2H2O+
CaCO3↓+2H2O+![]() ,C项正确,不符合题意;
,C项正确,不符合题意;
D. 在0.5 mol·L1的K2Cr2O7溶液中存在如下平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+,其平衡常数的表达式为
+2H+,其平衡常数的表达式为![]() ,在溶液中的水不写入表达式中,D项正确,不符合题意;
,在溶液中的水不写入表达式中,D项正确,不符合题意;
答案选A。


科目:高中化学 来源: 题型:
【题目】砷As是第四周期ⅤA族元素,可以形成 As2S3、As2O5、H3AsO3、H3AsO4等 化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣主要成分为As2S3制成浆状,通入O2氧化,生成H3AsO4和单质硫,写出发生反应的化学方程式___________;该反应需要在加压下进行,原因是___________.
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H =___________
(4)298K时,将20mL 3x molL-1 Na3AsO3、20mL 3x molL-1 I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
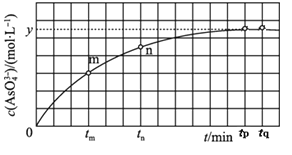
①下列可判断反应达到平衡的是 ______ 填标号.
a .溶液的pH不再变化 b. v(I-)=2v(AsO33-)
c .c (AsO43-)/c (AsO33-)不再变化 d. c(I-)=ymolL-1
②tm时v正_____v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v正(填“大于”“小于”或“等于”)理由是 _____
④若平衡时溶液c(OH-)=1 mol/L,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有![]() 、
、![]() 两种溶液,选择填空:
两种溶液,选择填空:
A. ![]()
(1)当它们pH相同时,其物质的量浓度______.
(2)当它们的物质的量浓度相同时,其pH的关系是______.
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为______.
(4)体积和物质的量浓度相同的![]() 、
、![]() 两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______.
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为______.
(6)将pH相同的两种酸均稀释10倍后,pH关系为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数表达式K=_________________
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_______平衡常数K值___(均填增大,减小或不变).
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态________(选填是或否),此时化学反应速率v正____v逆(选填>,<,=)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
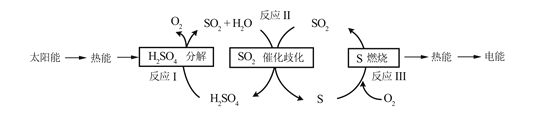
(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
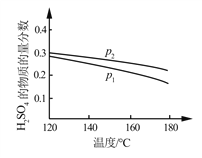
p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )。
A.2H2(g) + O2(g) = 2H2O(1) △H = - 484 kJ·mol-1
B.H2O(g) = H2(g) + ![]() O2(g) △H = + 242 kJ·mol-1
O2(g) △H = + 242 kJ·mol-1
C.H2(g) + ![]() O2(g) = H2O(g) △H = + 242 kJ·mol-1
O2(g) = H2O(g) △H = + 242 kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H = + 484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
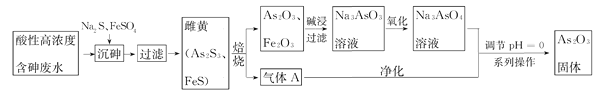
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
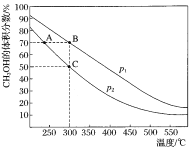
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com