
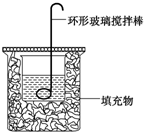
 某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.
某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验.| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
分析 (1)根据量热计的构造来判断该装置的缺少仪器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平,两烧杯之间塞满碎泡沫塑料;
(2)环形玻璃搅拌棒搅拌溶液的方法是上下搅拌,使溶液混合均匀;
(3)氢氧化钠溶液稍过量的原因是保证盐酸能够完全被中和;氢氧化钠固体溶于水放出热量;
(4)先根据表中测定数据计算出混合液反应前后的温度差,判断有效性,求出平均值,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热;
(5)先判断温度差的有效性,然后求出温度差平均值;
解答 解:(1)由量热计的构造可知该装置的缺少仪器是温度计;两烧杯之间塞满碎泡沫塑料是为了减少热量的损失;
故答案为:温度计;保温隔热,减少热量损失;
(2)在中和热测定实验中,环形玻璃搅拌棒搅拌溶液的方法是上下搅拌,使溶液混合均匀;
故选a;
(3)实验中NaOH过量,为了能保证盐酸溶液完全被中和,从而提高实验的准确度;氢氧化钠固体溶于水放热,温度偏高,所以实验中测得的“中和热”数值将偏大;
故答案为:保证盐酸能够完全被中和; 偏大;
(4)第1次实验反应前后温度差为:3.3℃;第2次反应前后温度差为:3.4℃;第3次实验反应前后温度差为:3.5℃,均有效,平均值为3.4℃,
0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL的质量和m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为$\frac{1.4212kJ×1mol}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(5)三次温度差分别为:①2.3℃②2.4℃③2.9℃,第③组数据舍去,温度差平均值=$\frac{2.3℃+2.4℃}{2}$=2.35℃;
故答案为:2.35.
点评 本题考查热测定原理及反应热的计算,题目难度大,注意理解中和热的概念以及测定反应热的误差等问题.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 100℃纯水的pH=6,说明加热可导致水呈酸性 | |
| B. | pH=4的醋酸溶液,稀释至10倍后pH=5 | |
| C. | 0.2mol/L的盐酸,与等体积水混合后pH=1 | |
| D. | 25℃时,pH=3的醋酸溶液.与pH=11的NaOH溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与B具有相同的电子层数 | |
| B. | A的金属活动性顺序排在Zn之后 | |
| C. | A与B能生成A2B3型固态化合物 | |
| D. | A元素的单质与B元素单质反应时,每消耗9 g A的同时消耗16g B |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦⑧ | B. | ③④⑤⑨⑩ | C. | ②③⑤⑩ | D. | ③④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com