
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
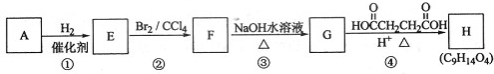
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
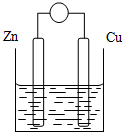 原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | |||
| 负极 | |||
| 总反应式 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体氯化铵和消石灰混合加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| B. | 硫化亚铁与盐酸反应:S2-+2H+═H2S↑ | |
| C. | 铜与稀硝酸:Cu+4H++2NO3-═Cu2++NO2↑+2H2O | |
| D. | 向氨水中通入过量的二氧化碳:NH3•H2O+CO2═NH4++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 热的浓盐酸可以除去试管内残留的MnO2 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32- | |
| D. | 施肥时,草木灰(有效成分为K2CO3)与NH4Cl混合使用,可以同时提供K、N两种有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,属于加聚反应(填反应类型).
,属于加聚反应(填反应类型).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com