
| A. | “西气东输”中的“气”指的是煤气 | |
| B. | 我国使用最早的合金为青铜,主要成分是 Cu 和 Sn | |
| C. | 自然界存在大量游离态的硫及硅 | |
| D. | 氮是动植物生长不可缺少的元素,是油脂的组成元素之一 |
分析 A.“西气东输”中的“气”指的是天然气;
B.铜金属性不活泼,在自然界有单质铜,青铜铸造性、耐磨性和耐腐蚀性好,青铜为合金;
C.硅元素在自然界中主要以化合态存在;
D.氮是动植物生长不可缺少的元素,是蛋白质的重要成分,油脂不含有氮元素.
解答 解:A.天然气的主要成分是甲烷,“西气东输”中的“气”不是煤气,故A错误;
B.人类使用金属的顺序正好和金属的活动性相反,金属活动性越强的金属越难冶炼,所以青铜是人类最早使用的铜锡合金,故B正确;
C.自然界存在大量游离态的硫,硅是亲氧元素,在自然界中主要以化合态存在,故C错误;
D.含氮的无机盐能促进细胞的分裂和生长,使枝繁叶茂,氮是蛋白质的重要成分,是动植物生长不可缺少的元素,油脂是高级脂肪酸甘油酯,不一定含有氮元素,故D错误;
故选B.
点评 本题考查了生活中的化学,掌握基础是关键,注意自然界存在大量游离态的硫,但没有游离的硅,为易错点,题目较简单.


科目:高中化学 来源: 题型:填空题
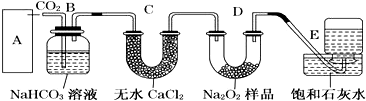
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
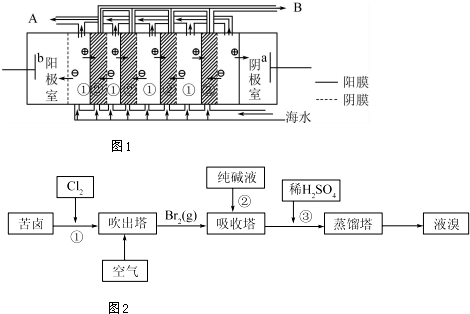
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂.目前主要的合成方法有电解法、高温固相法等.| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
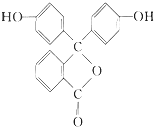
| A. | 酚酞具有弱酸性,且属于芳香烃 | |
| B. | 酚酞的分子式为C19H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
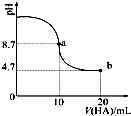 室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(HA)>c(A-) | |
| B. | 当加入HA溶液10ml时,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol•L-1 | |
| C. | a点所示溶液中c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
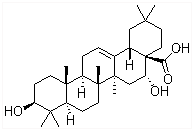 刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )
刺囊酸具有滋肝补血、凉血止血功能,结构式如图所示.下列关于刺囊酸的说法不正确的是( )| A. | 和氧所催化氧化后产物中含有醛基 | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 能发生取代、氧化、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
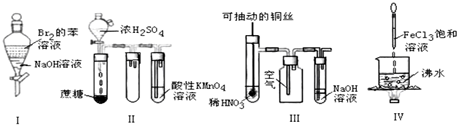
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:向沸水中滴加FeCl3溶液,继续煮沸溶液至红褐色,就可以制备FeCl3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
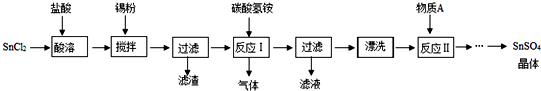
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com