

| A. | 合金一定比纯金属耐腐蚀 | |
| B. | 如图,在铁棒上产生气泡,碳棒上没有气泡 | |
| C. | 在锌与稀硫酸反应时,加入硫酸铜溶液可以加快反应速率 | |
| D. | 铝不需要特别处理就具有抗腐蚀能力 |
分析 A、合金中做负极金属的腐蚀程度增大、速度加快;
B、在原电池的正极上产生气泡,在负极上金属被腐蚀;
C、锌与稀硫酸反应时,加入硫酸铜溶液可以构成原电池装置,从而加快反应速率;
D、金属铝的表面容易形成一层致密的氧化物薄膜.
解答 解:A、合金中,做负极金属的腐蚀程度增大、速度加快,易被腐蚀,故A错误;
B、如图原电池中的,负极是金属铁,正极是碳棒,铁棒质量减轻,碳棒上有气泡,故B错误;
C、锌与稀硫酸反应时,加入硫酸铜溶液,可以构成锌-铜-硫酸原电池装置,从而加快负极金属锌和硫酸之间的反应速率,故C正确;
D、金属铝的表面容易形成一层致密的氧化物薄膜,起到保护内部金属的作用,即铝不需要特别处理就具有抗腐蚀能力,故D错误.
故选C.
点评 本题考查学生原电池的工作原理,注意原电池的构成条件和金属的防护知识,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝化甘油在体内能够分解出NO,少量的NO会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛 | |
| B. | TNT爆炸的方程式为:2C7H5N3O6(s)→6CO2(g)+5H2(g)+3N2(g)+8C(s),因而爆炸过程会产生大量的黑烟 | |
| C. | 为迎接G20峰会,全市努力植树造林,节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| D. | 用中子轰击Hg核能发生下面的反应:80196Hg+01n→80197Hg→79197Au+e+制得金核,这个过程不属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O 只存在于乙酸乙酯中 | B. | 18O 只存在于水中 | ||
| C. | 18O 只存在于乙醇和乙酸乙酯中 | D. | 18O 只存在于乙醇和水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
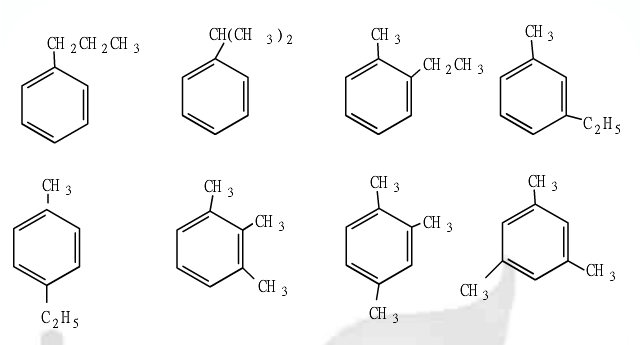 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
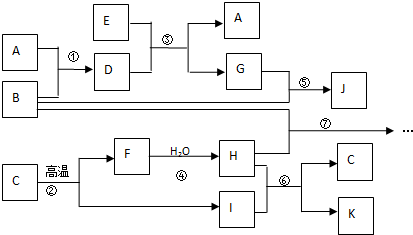
 ,化合物K的电子式为
,化合物K的电子式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com