
【题目】非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
⑴ O2-的电子式为___________;
⑵ O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
⑶ CH3OH在常温下为液态,沸点高于乙烷的主要原因是__________________________;
⑷ Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
危险性 |
|
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用____________________________。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是_________________。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中
c(Cl-) : c(ClO-)=11 : 1时,则c(ClO-) :c(ClO3-)比值等于_____________。
⑸ 镁是一种较活泼的金属, Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式___________________________。
【答案】![]() ClO2、O3、Cl2甲醇分子之间能形成氢键而乙烷不能HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-Fe(或者FeCl3)能催化苯与氯气的反应1:2MgC2 + 2H2O = Mg(OH)2 + C2H2↑
ClO2、O3、Cl2甲醇分子之间能形成氢键而乙烷不能HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-Fe(或者FeCl3)能催化苯与氯气的反应1:2MgC2 + 2H2O = Mg(OH)2 + C2H2↑
【解析】
(1)氧原子序数为8,O2-最外层电子数为8,阴离子加括号,标电荷,因此O2-的电子式为![]() ;
;
因此,本题正确答案是:![]() ;
;
(2)O、Cl两元素形成的单质常用来消菌杀毒的有O3、Cl2,化合物有ClO2,
因此,本题正确答案是:ClO2、O3、Cl2;
(3)甲醇(CH3OH)分子之间能形成氢键而乙烷不能,故其沸点高于乙烷,
因此,本题正确答案是:甲醇分子之间能形成氢键而乙烷不能;
(4)①液氯泄漏处理用NaOH或NaHSO3溶液吸收,其中与NaHSO3溶液反应原理为HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-;
②钢瓶中Fe单质可以与Cl2反应生成FeCl3,FeCl3能催化苯的氯代反应;
③Cl2通入KOH溶液发生氧化还原反应,部分氯元素由0价将至-1,部分氯元素由0价升至+1(ClO-)、+5(ClO3-),c(Cl-) : c(ClO-)=11 : 1,设ClO-物质的量为xmol,则Cl-物质的量为11 xmol,该氧化还原反应中,化学价降低得到的电子物质的量为11 xmol,化学价升高至+1失去的电子物质的量为xmol,则化学价升高至+5失去的电子物质的量为11 xmol - xmol =10 xmol ,则n(ClO3-)=![]() =2xmol,则c(ClO-) :c(ClO3-)=x:2x=1:2。
=2xmol,则c(ClO-) :c(ClO3-)=x:2x=1:2。
因此,本题正确答案是:HSO3- + Cl2 + H2O = SO42- + 3H+ + 2Cl-;Fe(或者FeCl3)能催化苯与氯气的反应;1:2;
(5)根据气体的物质的量和溴水增重质量可知该气体的相对分子质量为26,Ca与C形成常见易水解的离子化合物为电石CaC2,CaC2水解的方程式为:CaC2+ 2H2O = Ca (OH)2 + C2H2↑,乙炔的相对分子质量为26,符合题目要求,钙镁化学性质相似,故镁碳化合物水解后的化学方程式为MgC2 + 2H2O = Mg(OH)2 + C2H2↑。
因此,本题正确答案是:MgC2 + 2H2O = Mg(OH)2 + C2H2↑。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组用锡粒制备氯化锡![]() 和氯化亚锡
和氯化亚锡![]() ,流程如下:
,流程如下:
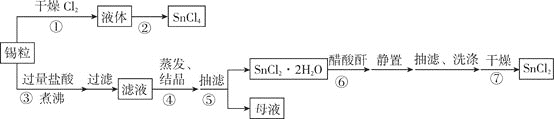
制备![]() 的装置如图:
的装置如图:
已知:![]() 为无色液体,熔点
为无色液体,熔点![]() ,沸点
,沸点![]() ,遇水强烈水解,可溶于乙醇、四氯化碳等。
,遇水强烈水解,可溶于乙醇、四氯化碳等。![]() 为白色晶体,在空气中加热会发生水解及氧化。
为白色晶体,在空气中加热会发生水解及氧化。![]() 为白色晶体,熔点
为白色晶体,熔点![]() ,沸点
,沸点![]() ,易溶于水、乙醇、冰醋酸,极易溶于盐酸。
,易溶于水、乙醇、冰醋酸,极易溶于盐酸。
请回答:
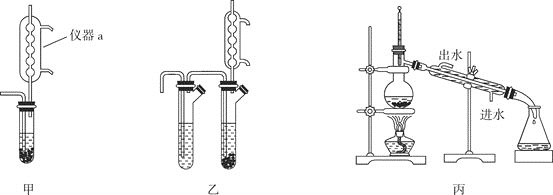
![]() 步骤
步骤![]() 的反应装置如图甲,其中仪器a的作用为________。若用图乙代替图甲作为反应装置,优点是在不拆除装置的情况下,向支管不断填装锡粒大量制备
的反应装置如图甲,其中仪器a的作用为________。若用图乙代替图甲作为反应装置,优点是在不拆除装置的情况下,向支管不断填装锡粒大量制备![]() ,则制备过程中将生成的
,则制备过程中将生成的![]() 转移至蒸馏烧瓶中的简易操作为________。
转移至蒸馏烧瓶中的简易操作为________。
![]() 步骤
步骤![]() 的装置如图丙,此装置存在一处明显的缺陷为________。
的装置如图丙,此装置存在一处明显的缺陷为________。
![]() 步骤
步骤![]() 选择的实验仪器为铂皿,比用玻璃仪器或陶瓷仪器更好,其理由为________。
选择的实验仪器为铂皿,比用玻璃仪器或陶瓷仪器更好,其理由为________。
![]() 步骤
步骤![]() 中的反应需在搅拌下进行,该反应的化学方程式为________。
中的反应需在搅拌下进行,该反应的化学方程式为________。
![]() 关于
关于![]() 的制备,下列说法不正确的是________。
的制备,下列说法不正确的是________。
A.步骤![]() 蒸发及步骤
蒸发及步骤![]() 干燥时均需在真空环境下进行
干燥时均需在真空环境下进行
B.步骤![]() 抽滤操作中,将晶体转移至布氏漏斗时,若有晶体附着在烧杯内壁,应用蒸馏水将烧杯内壁的晶体淋洗至布氏漏斗中,以提高产率
抽滤操作中,将晶体转移至布氏漏斗时,若有晶体附着在烧杯内壁,应用蒸馏水将烧杯内壁的晶体淋洗至布氏漏斗中,以提高产率
C.为提高产品纯度,可在含醋酸酐的冰醋酸中重结晶
D.![]() 在干燥
在干燥![]() 或干燥HCl气流中加热也可得到无水
或干燥HCl气流中加热也可得到无水![]()
E.若步骤![]() 产生的母液较多,可进一步浓缩母液以提高产品纯度
产生的母液较多,可进一步浓缩母液以提高产品纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
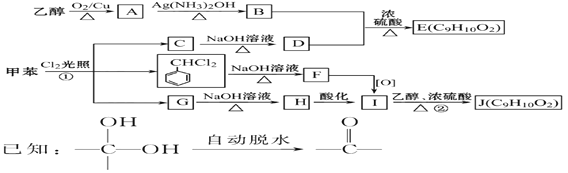
请回答:
(1)①的反应类型为_________________; J的官能团名称是_______________;
(2)D的化学名称是_________________________, F的结构简式为__________________________。
(3)写出下列反应方程式
①乙醇→A: ________________________________________________________。
② C→D:________________________________________________________。
③B+D→E: _____________________________________________________。
④G→H:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家首次合成的一种过渡金属的新核素![]() ,不易被腐蚀,可应用于高科技领域。185Hf可由180Hf转化而成,下列说法正确的是( )
,不易被腐蚀,可应用于高科技领域。185Hf可由180Hf转化而成,下列说法正确的是( )
A. 185Hf与180Hf质量数相同
B. 180Hf、185Hf在周期表中的位置不同
C. 1 mol 180Hf比1 mol 185Hf的中子数少5NA
D. 180Hf 和185Hf核外电子数分别为108、113
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下列装置制取收集纯净的氯气,并研究其性质。请回答下列问题。

(1)装置甲中仪器A的名称是________,丙中应装的溶液是_______ ,甲装置中发生反应的离子方程式为_____________ 。制取收集纯净氯气的装置接口连接顺序是a→ …→g(补充完整)_________。
(2)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
I方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
Ⅱ方案:采用酸碱中和滴定法测定。
Ⅲ方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
继而进行下列判断和实验:
①判定I方案不可行,理由是__________________;
②进行Ⅱ方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL于锥形瓶中,若锥形瓶中存有少量水,对实验结果是否有影响?_____填“是”或“否” )。用0.10 molL-1NaOH标准溶液滴定,消耗NaOH标准溶液的体积如图所示 ,其读数为 _____mL.

b.平行滴定后获得实验结果
③判断Ⅲ方案的实验结果___________(填“偏大”、“偏小”或“准确”)。[已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11
(3) 某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下金属元素的原子失电子能力逐渐增强;同一周期,从左到右金属元素的原子失电子能力逐渐___________________;
(2)反应最剧烈的烧杯中金属是_______(填字母序号);
A.钠 B.镁 C.铝 D.钾
(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_________(填字母序号)。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题
(1)实验装置:
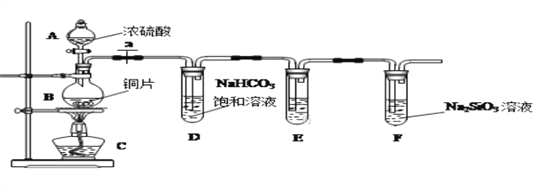
(1)填写所示仪器名称:B__________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________;试管F中发生反应的离子方程式为_____________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它的制备方法如下图所示,下列说法正确的是
![]()
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 灼烧熔融的Na2CO3固体,可用石英坩埚
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点67.6℃),可通过蒸馏(或分馏)提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 在所有分子中都存在化学键
B. 在任何情况下,都是σ键比π键强度大
C. 共价键的成键原子只能是非金属原子
D. 分子的稳定性与分子间作用力的大小无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片。下列叙述不正确的是( )
A. 铜片上有H2逸出 B. 电子通过导线由铜片流向锌片
C. 反应一段时间后,溶液的H+ 浓度降低 D. 负极附近的SO42-离子浓度逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com