
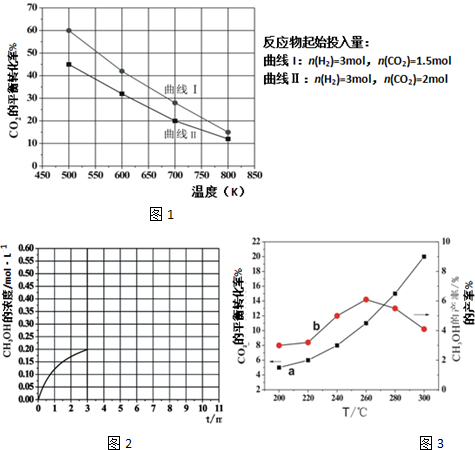
| △c |
| △t |
| 1.35mol/L |
| 10min |
| 0.45×0.45 |
| 0.3×0.153 |
 ,
, ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题:
前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①② | B、①④ | C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①溶液中:c(A?)>c(Na+)>c(OH?)>c(H+) |
| B、①溶液中:c(HA)+c(A-)=0.1mol/L |
| C、常温下,0.1mol/LHA溶液的pH=1 |
| D、0.1mol/LHA溶液中:c(HA)>c(A?) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、化合物 的分子式为C13H9O4N2 的分子式为C13H9O4N2 |
| B、CH3(CH2)2CH3与CH(CH3)3具有不同数目的一氯代物 |
| C、在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 |
| D、石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com