

分析 由转化关系可知A为Cl2,加入过量BaCl2溶液,产生沉淀,说明X水解生成SO42-,则X中含有S、Cl元素,且S为+6价,应为SO2Cl2或SCl2O2,水解可生成硫酸和盐酸,1molSO2Cl2可水解生成1mol硫酸,2molHCl,13.5gX的物质的量为$\frac{13.5g}{135g/mol}$=0.1mol,可与0.4molNaOH中和,符合题意,则C为SO2,B为酸,以此解答该题.
解答 解:(1)由以上分析可知Na2SO3和B反应生成C为二氧化硫,B为酸,反应的离子方程式为SO32-+2H+═SO2↑+H2O,故答案为:SO32-+2H+═SO2↑+H2O;
(2)由以上分析可知X为SO2Cl2或SCl2O2,由二氧化硫被氯气氧化生成,C表现还原性,故答案为:SO2Cl2或SCl2O2; 还原.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,注意把握题给信息以及相关数据的处理,把握物质的性质,难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液和胶体的本质区别为是否能产生丁达尔效应 | |
| B. | K2Cr2O7溶液和氢溴酸能存放于同一药品橱内 | |
| C. | 用带玻璃塞的细口试剂瓶保存氢氟酸 | |
| D. | CH4和C2H4均属于常用危险品中的易燃气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Cu2++Fe2+ | |
| B. | 等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-═2CaCO3↓+2H2O+CO32- | |
| D. | 新制饱和氯水中加入石灰石可提高溶液中HClO浓度:CaCO3+2Cl2+H2O═Ca2++2Cl-+CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质升华,克服的是其分子间作用力 | |
| B. | 金刚石、石墨、纳米碳管是碳元素的同素异形体 | |
| C. | 目前科学家还无法实现对原子或分子的操纵 | |
| D. | HCl气体溶于水后,共价键被破坏,从而形成了H+和Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟利昂-12的结构式为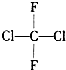 ,该分子是平面型分子 ,该分子是平面型分子 | |
| B. | 苯与液溴混合后撤入铁粉发生了加成反应 | |
| C. | 分子式为C4H9Cl的同分异构体共有4种 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作步骤 | 实验现象 | 结论 |
| 取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份. | ||
| 一份加入足量稀盐酸后,再加入BaCl2溶液. | 有白色沉淀生成. | 证明雾霾固体中含有SO42- |
| 另一份加入适量的NaOH浓溶液并加热. | 产生使湿润的红色石蕊试纸变蓝色的气体. | 证明雾霾固体中含有NH4+.综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X>Y>Z>M | |
| B. | XZ2为直线形的共价化合物 | |
| C. | X、Y、Z 分别与M元素形成的最简单化合物的沸点依次升高 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com