
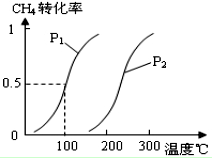
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
分析 (1)CH4(g)+H2O(g)?CO(g)+3H2(g)为气体体积增大的反应,增大压强,反应速率增大,平衡逆向移动;
(2)由图可知,升高温度,甲烷的转化率增大,K为生成物浓度幂之积与反应物浓度幂之积的比,100℃时的甲烷转化率为0.5,则
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始0.02 0.03 0 0
转化0.01 0.01 0.01 0.03
平衡0.01 0.02 0.01 0.03
结合平衡浓度计算K;
(3)寻找合成甲醇的温度和压强的适宜条件,则实验I和II只有压强不同,II和III只有温度不同,以此来解答.
解答 解:(1)CH4(g)+H2O(g)?CO(g)+3H2(g)为气体体积增大的反应,增大压强,反应速率增大,平衡逆反应方向或左移动,
故答案为:增大; 逆反应方向或左;
(2)由图可知,升高温度,甲烷的转化率增大,即升高温度平衡正向移动,可知△H1>0;K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$,100℃时的甲烷转化率为0.5,则
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始0.02 0.03 0 0
转化0.01 0.01 0.01 0.03
平衡0.01 0.02 0.01 0.03
K=$\frac{0.01×(0.03)^{3}}{0.01×0.02}$=1.35×10-3,
故答案为:>;$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$;1.35×10-3;
(3)寻找合成甲醇的温度和压强的适宜条件,则实验I和II只有压强不同,II和III只有温度不同,则II中数据分别为150、1/3,III中数据为1/3,故答案为:
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | |||
| II | 150 | 1/3 | |
| III | 1/3 |
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、探究平衡移动的影响因素为解答的关键,侧重分析与计算能力的考查,注意(3)中控制变量法应用,题目难度不大.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 第3周期ⅡB族 | B. | 第4周期ⅡB族 | C. | 第4周期ⅦB族 | D. | 第4周期Ⅷ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )| A. | p3<p4,Y轴表示A的转化率 | |
| B. | p3>p4,Y轴表示混合气体的密度 | |
| C. | p3<p4,Y轴表示B的浓度 | |
| D. | p3>p4,Y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ①②④③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com