
A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大,已知:B的最外层电子排布是ns2npn+1;C的p能级上未成对的电子比B少一个;D的二价阳离子与C的阴离子具有相同的电子层结构;E与D同周期且E在该周期中原子半径最小;B与A的单质能生成具有刺激性气味的气体。
(1)B原子核外电子排布式为________。
(2)A与E化合时原子间以________键相结合,D与C化合时原子间以
________键相结合。
(3)写出A、C的单质直接化合形成的化合物与E单质反应的离子方程式:
__________________________________________________________________
_________________________________________________________________。
(4)A与B形成化合物时,中心原子采取________杂化成键,其立体结构为
________,属于________(填“极性”或“非极性”)分子。
解析 由B的最外层电子排布是ns2npn+1可推知,短周期中符合条件的为N:
2s22p3,S:3s23p4,又因为A、B、C、D、E五种元素原子序数依次增大,
知B为氮元素;C的p能级上未成对电子比B少一个,则C的最外层电子排
布应为2s22p4,为氧元素;D的二价阳离子与C的阴离子具有相同的电子层
结构,可知D为Mg。E与D同周期且E在该周期中原子半径最小,故E为
第三周期中原子半径最小的Cl,而与N2生成具有刺激性气味的气体的单质
为H2,即A为H。
答案 (1)1s22s22p3 (2)共价 离子 (3)Cl2+H2O===H++Cl-+HClO
(4)sp3 三角锥形 极性


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在一定温度下,向一个容积不变的容器中,通入2 mol A2和8 mol B2及固体催化剂,使之反应。已知:A2(g)+3B2(g)
 2AB3(g) ΔH=-Q kJ·mol-1。平衡时容器内气体压强为起始时的80%。
2AB3(g) ΔH=-Q kJ·mol-1。平衡时容器内气体压强为起始时的80%。
(1)平衡时容器内AB3的体积分数为________。
(2)加入2 mol A2和8 mol B2,达平衡时,放出热量为________(填序号)。
A.小于Q kJ B.等于Q kJ
C.大于Q kJ D.可能大于或小于或等于Q kJ
(3)在相同的容器中,降低温度,通入2 mol AB3和1 mol B2及固体催化剂,反应达平衡时对AB3的体积分数,下列判断正确的是________(填序号)。
A.一定等于1/4 B.一定大于1/4
C.一定小于1/4 D.可能大于或小于或等于1/4
理由是_________________________________________________________________。
(4)保持同一温度,在相同容器中,起始通入一定物质的量的A2、B2、AB3,欲使平衡时AB3的体积分数为1/4,且起始时反应表现为向正反应方向进行,则充入A2的物质的量a mol的取值范围是_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制备乙酸乙酯的化学方程式:CH3COOH+C2H5OH
 CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
CH3COOC2H5+H2O,为证明浓硫酸在该反应中起到了催化剂和吸收剂的作用,某同学利用下图所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 2 mL乙醇、2 mL乙酸、1 mL 18 mol·L-1浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3 mL乙醇、2 mL乙酸 | 0.1 | |
| C | 3 mL乙醇、2 mL乙酸、6mL 3 mol·L-1硫酸 | 1.2 | |
| D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
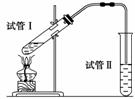 (1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(1)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol/L。
(2)分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是___________________________________________________________________
_________________________________________________________________。
(3)加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是___________________________________________________________________
____________________________________________________(答出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是 ( )。
A.氯化硼液态时能导电而固态时不导电
B.氯化硼中心原子采用 sp杂化
C.氯化硼分子呈正三角形,属非极性分子
D.其分子空间结构类似NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应式为2CH3OH+3O2+4OH-
 2CO
2CO +6H2O,则下列有关说法错误的是( )
+6H2O,则下列有关说法错误的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应式为CH3OH-6e-+8OH-===CO +6H2O
+6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知α氨基酸在一定条件下能与亚硝酸(HNO2)反应得到α羟基酸。如:

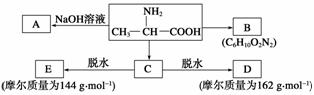
(1)写出A、B的结构简式:A_______________________________________________;
B________________________________________________________________________。
(2)写出C→D的化学方程式:______________________________________________。
(3)写出C→E的化学方程式:______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com