
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ( )。
A.2NaW+Z2===2NaZ+W2
B.2NaX+Z2===2NaZ+X2
C.2NaW+Y2===2NaY+W2
D.2NaZ+X2===2NaX+Z2
科目:高中化学 来源: 题型:
能源分类相关图如下图所示,下列四组选项中,全部符合图中阴影部分的能源是( )
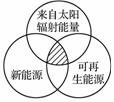
A.煤炭、石油、沼气
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、核能
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅(熔点1 410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)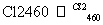 SiCl4
SiCl4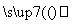 SiCl4(纯)
SiCl4(纯)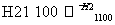 Si(纯)
Si(纯)
写出SiCl4的电子式:______________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是 ( )。
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO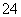 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
③Cl2+H2O===H++Cl-+HClO
④CO +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
A.只有③ B.②③
C.③⑤ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
| 阳离子 | K+ Ag+ Mg2+ Ba2+ |
| 阴离子 | NO |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是________。
(2)实验Ⅰ中生成沉淀的离子方程式为________________________________________________________________
______________________________________________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
| 阴离子 | NO | CO | SiO | SO |
| c/(mol·L-1) |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是________。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是________(填编号)。
A.NaCl B.NH4Cl
C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:□Al+□NaNO3+□NaOH===□NaAlO2+□N2↑+2H2O。若反应过程中转移5 mol e-,则生成标准状况下N2的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气, 减小
减小
B.通入少量SO2,溶液漂白性增强
C.加入少量的碳酸钠粉末,pH增大,溶液漂白性增强
D.光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免________________________________________________________________________。
(2)Br2可用热空气吹出,其原因是________________________________________________________________________。
(3)写出步骤③所发生的化学反应方程式________________________________________________________________________。
用硫酸而不用盐酸酸化的原因可能是______________。步骤②的产品有时运输到目的地后再酸化,主要是因为
________________________________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中________________________________________________________________________。
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,则HCl和NaOH的物质的量浓度之比是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com