
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢EĪåÖÖ¶ĢÖÜĘŚŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£AŗĶC£¬BŗĶEĶ¬Ö÷×壬C”¢D”¢EĶ¬ÖÜĘŚ”£ÓÉA”¢B×é³ÉµÄĮ½ÖÖ»ÆŗĻĪļ¼×ŗĶŅŅ¶¼ĪŖŅŗĢ¬£¬¼×ÖŠA”¢BŌ×ÓŹżÖ®±ČĪŖ2£ŗ1£¬ŅŅÖŠĪŖ1£ŗ1”£ÓÉB”¢C×é³ÉµÄĮ½ÖÖ»ÆŗĻĪļ±ūŗĶ¶”¶¼ĪŖ¹ĢĢ¬£¬±ūÖŠC”¢BŌ×ÓŹżÖ®±ČĪŖ2£ŗ1£¬¶”ÖŠĪŖ1£ŗ1”£C”¢D”¢EµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĮ½Į½Ö®¼ä¾łÄÜ·¢Éś·“Ó¦£¬ĒŅ¾łÓŠ¼×Éś³É£¬ĒŅAĪŖŌ×Ó°ė¾¶×īŠ”µÄ¶ĢÖÜĘŚŌŖĖŲ£¬¶”ĪŖµ»ĘÉ«¹ĢĢ唣Ōņ£ŗ
£Ø1£©DµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ£ŗ__________________
£Ø2£©AŌŖĖŲµÄµ„ÖŹĪŖ£ŗ_____________£ØĢī»ÆѧŹ½£©£»¶”µÄµē×ÓŹ½ĪŖ£ŗ_____________
£Ø3£©EŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ_________________________________
£Ø4£©C”¢DµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ
____________________________________________________________ӣ
”¾“š°ø”æ 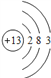 H2
H2 ![]() µŚČżÖÜĘŚµŚVIA×å OH-+Al£ØOH£©3=AlO2-+2H2O
µŚČżÖÜĘŚµŚVIA×å OH-+Al£ØOH£©3=AlO2-+2H2O
”¾½āĪö”æA”¢B”¢C”¢D”¢EĪåÖÖ¶ĢÖÜĘŚŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£AĪŖŌ×Ó°ė¾¶×īŠ”µÄ¶ĢÖÜĘŚŌŖĖŲ£¬AĪŖHŌŖĖŲ”£ÓÉA”¢B×é³ÉµÄĮ½ÖÖ»ÆŗĻĪļ¼×ŗĶŅŅ¶¼ĪŖŅŗĢ¬£¬¼×ÖŠA”¢BŌ×ÓŹżÖ®±ČĪŖ2£ŗ1£¬ĪŖH2O£¬ŅŅÖŠĪŖ1£ŗ1ĪŖH2O2£¬ŌņBĪŖOŌŖĖŲ£»AŗĶC£¬BŗĶEĶ¬Ö÷×壬ŌņCĪŖNaŌŖĖŲ£¬EĪŖSŌŖĖŲ£»C”¢D”¢EĶ¬ÖÜĘŚ”£ÓÉB”¢C×é³ÉµÄĮ½ÖÖ»ÆŗĻĪļ±ūŗĶ¶”¶¼ĪŖ¹ĢĢ¬£¬±ūÖŠC”¢BŌ×ÓŹżÖ®±ČĪŖ2£ŗ1£¬ĪŖŃõ»ÆÄĘ£¬¶”ÖŠĪŖ1£ŗ1£¬¶”ĪŖµ»ĘÉ«¹ĢĢ壬ĪŖ¹żŃõ»ÆÄĘ”£C”¢D”¢EµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĮ½Į½Ö®¼ä¾łÄÜ·¢Éś·“Ó¦£¬ĒŅ¾łÓŠ¼×Éś³É£¬ŌņDĪŖAlŌŖĖŲ”£
(1)DĪŖAlŌŖĖŲ£¬Ō×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ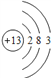 £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ £»
£»
(2)AĪŖHŌŖĖŲ£¬AŌŖĖŲµÄµ„ÖŹĪŖH2£»¶”ĪŖ¹żŃõ»ÆÄĘ£¬µē×ÓŹ½ĪŖ![]() £¬¹Ź“š°øĪŖ£ŗH2£»
£¬¹Ź“š°øĪŖ£ŗH2£»![]() £»
£»
(3)EĪŖSŌŖĖŲ£¬ŌŚÖÜĘŚ±ķÖŠĪ»ÓŚµŚČżÖÜĘŚµŚVIA×壬¹Ź“š°øĪŖ£ŗµŚČżÖÜĘŚµŚVIA×壻
(4)ĒāŃõ»ÆÄĘÓėĒāŃõ»ÆĀĮ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖOH-+Al(OH)3=AlO2-+2H2O£¬¹Ź“š°øĪŖ£ŗOH-+Al(OH)3=AlO2-+2H2O”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆÓŚ¾»»ÆĘū³µĪ²ĘųµÄ·“Ó¦£ŗ2NO(g)+2CO(g)![]() 2CO2(g)+N2(g),ŅŃÖŖøĆ·“Ó¦ĖŁĀŹ¼«Āż£¬570KŹ±Ę½ŗā³£ŹżĪŖl”Į1059”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
2CO2(g)+N2(g),ŅŃÖŖøĆ·“Ó¦ĖŁĀŹ¼«Āż£¬570KŹ±Ę½ŗā³£ŹżĪŖl”Į1059”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®×°ÓŠĪ²Ęų¾»»Æ×°ÖƵÄĘū³µÅųöµÄĘųĢåÖŠ²»ŌŁŗ¬ÓŠNO»ņCO
B£®ĢįøßĪ²Ęų¾»»ÆŠ§ĀŹµÄ³£ÓĆ·½·ØŹĒÉżøßĪĀ¶Č
C£®ĢįøßĪ²Ęų¾»»ÆŠ§ĀŹµÄ×ī¼ŃĶ¾¾¶ŹĒŃŠÖĘøߊ§“߻ƼĮ
D£®570KŹ±øĆ·“Ó¦ÕżĻņ½ųŠŠµÄ³Ģ¶Čŗܓ󣬹ŹŹ¹ÓĆ“ß»Æ¼Į²¢ĪŽŹµ¼ŹŅāŅå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ[2016ŠĀæĪ±ź¢ń]»ÆѧÓėÉś»īĆÜĒŠĻą¹Ų”£ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ
A£®ÓĆ×ĘÉյķ½·ØæÉŅŌĒų·Ö²ĻĖæŗĶČĖŌģĻĖĪ¬
B£®Ź³ÓĆÓĶ·“ø“¼ÓČČ»į²śÉś³ķ»··¼ĢžµČÓŠŗ¦ĪļÖŹ
C£®¼ÓČČÄÜɱĖĄĮ÷øŠ²”¶¾ŹĒŅņĪŖµ°°×ÖŹŹÜČȱäŠŌ
D£®Ņ½ÓĆĻū¶¾¾Ę¾«ÖŠŅŅ“¼µÄÅضČĪŖ95%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀĮĶĮæó(Ö÷ŅŖ³É·ÖĪŖAl2O3£¬»¹ŗ¬ÓŠSiO2”¢Fe2O3)ŹĒ¹¤ŅµÉĻÖʱøŃõ»ÆĀĮµÄÖ÷ŅŖŌĮĻ£®¹¤ŅµÉĻĢįČ”Ńõ»ÆĀĮµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ

(1)³ĮµķAµÄ³É·ÖŹĒ£ØĢī»ÆѧŹ½£©_________”£
(2) ²½Öč¢ŚÖŠ¼ÓČė¹żĮæNaOHČÜŅŗ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£¬³żĮĖH++OH©=H2O»¹ÓŠ£ŗ
_____________________________”¢________________________________£»
(3) ²½Öč¢ŪÖŠĶØČė¹żĮæCO2ĘųĢå¶ų²»¼ÓČė¹żĮæŃĪĖįµÄĄķÓÉŹĒ___________________£»
(4) ×¼Č·³ĘČ”8gĀĮĶĮæóѳʷ£¬¼ÓČėŅ»¶ØĮæŹŌ¼ĮaµÄČÜŅŗ£¬Ź¹ĘäÖŠµÄAl2O3”¢Fe2O3Ē”ŗĆČܽā£»Č»ŗó£¬ĻņĀĖŅŗÖŠ¼ÓČė10mol”¤L£1µÄNaOHČÜŅŗ£¬²śÉś³ĮµķµÄÖŹĮæÓė¼ÓČėNaOHČÜŅŗµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾£¬Ōņѳʷ֊Al2O3µÄ°Ł·Öŗ¬ĮæĪŖ_________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÄܵ¼µēµÄŹĒ£Ø £©
A.ŅŗĢ¬ĀČ»ÆĒā
B.ŃĪĖį
C.¾Ę¾«
D.Ź³ŃĪ¾§Ģå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķĪŖŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬Ēė²ĪÕÕŌŖĖŲ¢Ł£¢ąŌŚ±ķÖŠµÄĪ»ÖĆ£¬ÓĆ»ÆѧÓĆÓļ»Ų“šĻĀĮŠĪŹĢā£ŗ

£Ø1£©¢ŁµÄŌŖĖŲ·ūŗÅĪŖ______£»¢ŚµÄŌŖĖŲ·ūŗÅĪŖ______£»¢ŪµÄŌŖĖŲ·ūŗÅĪŖ______£»¢ÜµÄŌŖĖŲ·ūŗÅĪŖ______£»¢ŻµÄŌŖĖŲ·ūŗÅĪŖ______£»¢ŽµÄŌŖĖŲ·ūŗÅĪŖ______£»¢ßµÄŌŖĖŲ·ūŗÅĪŖ______£»¢ąµÄŌŖĖŲ·ūŗÅĪŖ_______
£Ø2£©¢ŽµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ_________”£
£Ø3£©¢ąµÄĘųĢ¬Ēā»ÆĪļĪŖ_____________(Ģī»ÆѧŹ½)”£
£Ø4£©¢Ż¶ŌÓ¦µÄ¼īµÄ»ÆѧŹ½ĪŖ__________£»¢ŪµÄ×īøß¼Ūŗ¬ŃõĖįĪŖ___________”££ØĢī»ÆѧŹ½£©
£Ø5£©¢Ż”¢¢ŽŌŖĖŲµÄ½šŹōŠŌĒæČõŅĄ“ĪĪŖ___________”££ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹōÓŚµē½āÖŹµÄŹĒ
A£®ÕįĢĒ B£®¶žŃõ»ÆĮņ C£®Ė® D£®Ć¾Ģõ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼Ėį±µŹĒŅ»ÖÖÖŲŅŖµÄĪŽ»śŃĪ²śĘ·£¬¹ć·ŗÓ¦ÓĆÓŚ¹¤ŅµĢÕ“É”¢¹āѧ²£Į§”¢½ØÖžµČŠŠŅµ”£Ģ¼»Æ·ØÉś²śĢ¼Ėį±µµÄ¹¤ŅÕĮ÷³ĢŹ¾ŅāĶ¼ČēĻĀ£ŗ
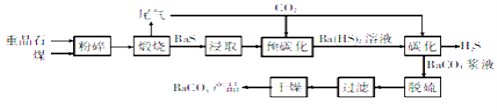
ŅŃÖŖ£ŗÖŲ¾§ŹÆµÄÖ÷ŅŖ³É·ÖŹĒBaSO4£»Ba(HS)2ČÜŅŗ³ŹČõ¼īŠŌ£»2BaS+2H2O=Ba(OH)2+Ba(HS)2”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ģŃÉÕŹ±·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £¬øĆ·“Ó¦µÄŃõ»Æ²śĪļµÄµē×ÓŹ½ĪŖ £»µ±ĪĀ¶Č¹żøߏ±£¬Ī²ĘųÖŠÓŠ¶¾ĘųĢåµÄŗ¬Įæ»įÉżøߣ¬ŌŅņŹĒ (ÓĆ»Æѧ·½³ĢŹ½±ķŹ¾)”£
(2)ĪŖĮĖĢįøß½žČ”ĖŁĀŹ£¬æɲÉČ”µÄ“ėŹ©ŹĒ (ČĪŠ“Ņ»ÖÖ)”£
(3)Ģ¼»ÆŹ±·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
(4)ĶŃĮņ¹ż³ĢŹĒÓĆNa2CO3ČÜŅŗ½«BaCO3½¬ŅŗÖŠŗ¬ÓŠµÄBaS2O3³żČ„£ŗCO32£+BaS2O3=BaCO3+S2O32££¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ ”¾ŅŃÖŖKsp(BaCO3)=2.5”Į10£9£¬Ksp(BaS2O3)=1.6”Į10£5”攣
(5)Ba(HS)2ČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ ”£
(6)BaCO3²»ÄÜÓĆÓŚŅ½ĮĘÓƵĔ°±µ²Ķ”±£¬ŌŅņŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌÖŲŅŖµÄ»Æ¹¤ŌĮĻA£ØC2H2£©ŗĻ³ÉÓŠ»śĪļEŗĶ![]() µÄĀ·ĻßČēĶ¼ĖłŹ¾£¬²æ·Ö·“Ó¦Ģõ¼ž¼°²śĪļĀŌČ„”£ĘäÖŠDŌŚŅ»¶ØĢõ¼žĻĀæɱ»Ńõ»Æ³ÉĶŖ”£
µÄĀ·ĻßČēĶ¼ĖłŹ¾£¬²æ·Ö·“Ó¦Ģõ¼ž¼°²śĪļĀŌČ„”£ĘäÖŠDŌŚŅ»¶ØĢõ¼žĻĀæɱ»Ńõ»Æ³ÉĶŖ”£
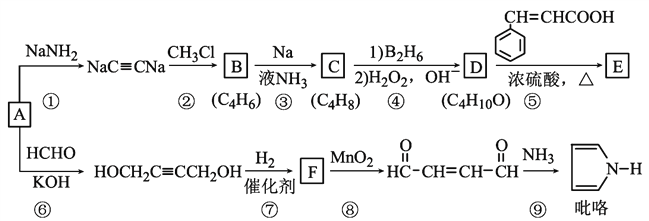
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©BµÄĻµĶ³ĆüĆūŹĒ______£»ŅŃÖŖCŹĒĖ³Ź½²śĪļ£¬ŌņCµÄ½į¹¹¼ņŹ½ĪŖ_______________”£
£Ø2£©¢ŻµÄ·“Ó¦ĄąŠĶŹĒ_________________£¬Eŗ¬ÓŠµÄ¹ŁÄÜĶŵÄĆū³ĘŹĒ________________”£
£Ø3£©·“Ó¦¢ą²śĪļÓėŠĀÖĘCu(OH)2µÄ»Æѧ·½³ĢŹ½ĪŖ____________________”£
£Ø4£©·ūŗĻĻĀĮŠĢõ¼žČā¹šĖį£Ø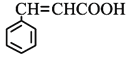 £©µÄĶ¬·ÖŅģ¹¹Ģå¹²____ÖÖ£¬·Ö×ÓÖŠŗ¬ÓŠ±½»·ŗĶĢ¼Ģ¼Ė«¼ü£¬Äܹ»·¢ÉśŅų¾µ·“Ó¦£¬ÓöFeCl3ČÜŅŗĻŌ×ĻÉ«£¬Š“³öĘäÖŠŗĖ“Ź²ÕńĒāĘ×Ķ¼ÓŠĮł×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ1:1:1:1:2:2µÄ½į¹¹¼ņŹ½____________________
£©µÄĶ¬·ÖŅģ¹¹Ģå¹²____ÖÖ£¬·Ö×ÓÖŠŗ¬ÓŠ±½»·ŗĶĢ¼Ģ¼Ė«¼ü£¬Äܹ»·¢ÉśŅų¾µ·“Ó¦£¬ÓöFeCl3ČÜŅŗĻŌ×ĻÉ«£¬Š“³öĘäÖŠŗĖ“Ź²ÕńĒāĘ×Ķ¼ÓŠĮł×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ1:1:1:1:2:2µÄ½į¹¹¼ņŹ½____________________
£Ø5£©²ĪÕÕÉĻŹöŗĻ³ÉĀ·Ļߣ¬Éč¼ĘŅ»ĢõÓɱūČ²ŗĶ¼×Č©ĪŖĘšŹ¼ŌĮĻÖʱø![]() µÄŗĻ³ÉĀ·Ļß__________________________”£
µÄŗĻ³ÉĀ·Ļß__________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com