
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| c(HCl)?V(HCl) |
| V(NaOH) |
| 27.83+27.85 |
| 2 |
| c(HCl)?V(HCl) |
| V(NaOH) |
0.1032mol/L×
| ||
| 0.025L |
0.1032×
| ||
| 25 |
0.1032×
| ||
| 25 |


科目:高中化学 来源: 题型:
| A、1mol甲苯含有6NA个C-H键 |
| B、25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA |
| C、标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
| D、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40 gNaOH溶于1L水中,所得NaOH溶液的浓度为1 mol?L-1 | ||
| B、将2.3gNa投入到97.7g水中充分反应,所得溶液中溶质的质量分数为4.0% | ||
C、在t℃时,将a g NH3完全溶液水,得到VmL溶液.该溶液的物质的量浓度为
| ||
| D、1 mol?L-1的硫酸溶液中c(H+)=1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
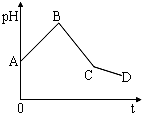 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A、整个过程中阳极先产生Cl2,后产生O2 |
| B、阳极极产物一定是Cl2,阴极产物一定是Cu |
| C、BC段表示在阴极上是H+放电产生了H2 |
| D、CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无氧酸是指分子组成中不含氧元素的酸,如HCl、CH4等 |
| B、和酸反应生成盐和水的物质一定是碱性氧化物 |
| C、所有的酸性氧化物都可以与水化合得到相应的酸 |
| D、根据溶解性的不同,可将碱分为难溶性碱和可溶性碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
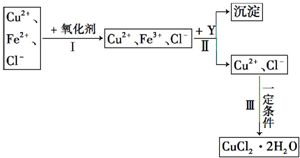 CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com