
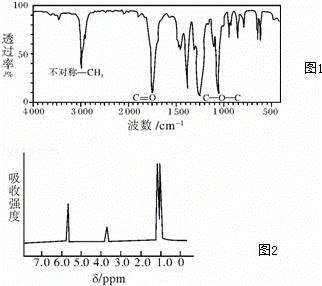
(1)如图1是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物可能的结构简式为 、 .
(2)已知1丙醇和2丙醇的结构简式如下:
1丙醇:CH3CH2CH2OH 2丙醇:
如图2是这两种物质中其中一种的核磁共振谱,并且峰面积比分别为1:1:6,
请指出该核磁共振谱表示的物质是 ,
(3)某有机化合物A的相对分子质量大于110,小于150.经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧.请回答:
①该化合物的相对分子质量是 .
②该化合物的化学式是 .
考点: 有机物实验式和分子式的确定;结构简式.
分析: (1)由红外光谱图可看出该分子中有不对称CH3,因此该分子中有2个CH3,由图也可以看出含有C=O双键,C﹣O﹣C单键,书写A的结构式,据此解答;
(2)根据该有机物的核磁共振谱中的峰面积比可以确定该有机物分子中含有的不同类型氢原子的种数,进而确定有机物的结构简式;
(3)根据含氧量和相对分子质量的范围,得出氧原子数的范围,最终确定分子中含有的氧原子数目;根据氧元素的质量分数、分子中含有的氧原子数目求出有机化合物的相对分子质量;根据相对分子质量和分子中含有的氧原子数目计算化学式.
解答: 解:(1)由红外光谱图可看出该分子中有不对称CH3,因此该分子中有2个CH3,由图也可以看出含有C=O双键,C﹣O﹣C单键.所以A的结构简式为CH3COOCH2CH3或是CH3CH2COOCH3,故答案为:CH3COOCH2CH3;CH3CH2COOCH3;
(2)根据该有机物的核磁共振谱中的峰面积比分别为1:1:6可知:该有机物分子中含有的不同位置氢原子有3种,分别含有氢原子数之比为1:1:6,1﹣丙醇(CH3﹣CH2﹣CH2﹣OH}中不同位置的氢原子有三种,其数目之比为1:3:4;
2﹣丙醇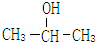 中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,所以满足条件的物质为:2﹣丙醇,
中不同位置的氢原子有三种,其氢原子数目之比为1:1:6,所以满足条件的物质为:2﹣丙醇,
故答案为:2﹣丙醇;
(3)①由题意知,氧的质量分数为47.76%,由有机化合物的相对分子质量大于110,小于150,
即分子中氧原子个数为大于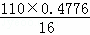 =3.28,小于
=3.28,小于 =4.48,所以氧原子为4个,
=4.48,所以氧原子为4个,
分子中氧原子为4个,氧的质量分数为47.76%,则有机化合物分子质量=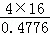 =134,
=134,
故答案为:134;
②分子中氧原子为4个,所以C、H的相对原子质量之和为:134﹣16×4= 70,可确定化学式为C5H10O4,故答案为:C5H10O4.
70,可确定化学式为C5H10O4,故答案为:C5H10O4.
点评: 本题考查了有机物分子式的确定,题目难度中等,计算确定氧原子数为解答该题的关键.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
按要求完成下列各题:
(1)用电子式表示Mg Cl2的形成过程.H2O的电子式为.
(2)质量相同的H2O和D2O所含质子数之比为.
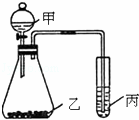
(3)利用如图装置采用适当试剂可完成某探究实验,并得出相应实验结论.请根据相关信息回答:
①为了证明元素的非金属性强弱是S>C>Si.你认为各物质应该是:甲为硫酸;乙为;丙为.(已知乙中有气泡产生,丙中有白色沉淀)
②如果甲为水,乙为Na2O2粉末,丙为H2S的饱和水溶液.实验中观察到丙中生成淡黄色沉淀.说明元素O、S非金属性强弱为.
查看答案和解析>>
科目:高中化学 来源: 题型:
我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
气体A的饱和溶液 A和食盐的饱和溶液
A和食盐的饱和溶液 悬浊液
悬浊液 晶体
晶体 纯碱
纯碱
则下列叙述错误的是()
A. A气体是CO2,B气体是NH3
B. 第Ⅲ步得到的晶体是发酵粉的主要成分
C. 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D. 第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤.正确的操作顺序是()
A. (1)(2)(3)(4) B. (4)(2)(3)(1) C. (4)(1)(2)(3) D. (2)(4)(2)(3)(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
为了检验某溴代烃中的溴元素,现进行如下操作,其中合理的是()
A. 取溴代烃少许,加入AgNO3溶液
B. 取溴代烃少许与NaOH水溶液共热,然后加入AgNO3溶液
C. 取溴代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液
D. 取溴代烃少许与NaOH水溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质的说法中正确的是 ( )。
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中评价不合理的是 ( )。
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 向碳酸镁中加入稀盐酸:CO | 错误,碳酸镁不应写成离子形式 |
| B | 向硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO | 正确 |
| C | 向FeCl3溶液中加入Fe粉:Fe3++Fe===2Fe2+ | 错误,离子所带电荷不守恒且电子得失不相等 |
| D | 以石墨作电极电解氯化钠溶液:2Cl-+2H2O | 正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是______________________________________________。
(2)混合气体的平均摩尔质量是______________________________________。
(3)CO2和CO的体积之比是_________________________________________。
(4)CO的体积分数是_______________________________________________。
(5)CO2和CO的质量之比是_________________________________________。
(6)CO的质量分数是_______________________________________________。
(7)混合气体中所含氧原子的物质的量是______________________________。
(8)混合气体中所含碳原子的物质的量是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是
A.物质的量浓度相等的三种溶液中,pH大小关系为:
pH( NaCN)> pH(Na2 CO3 )pH(CH3 COONa)
B.amol·L-1 HCN与6 mol·L-1 NaOH溶液等体积混合所得的溶液中
c(Na+)>c(CN-),则a一定小于b
C.向冰醋酸中逐滴加水稀释的过程中,溶液导电能力先增大,后减小
D.将0.1 mol·L-1的Na2 CO3溶液逐滴加入到等浓度的HCN溶液中,无明显现象,说明未反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com