
��������CO2����ͨ��KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ�������ͨ��CO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����е���������ȷ���ǣ�������
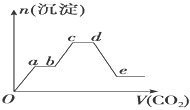
| �� | A�� | Oa�η�Ӧ�Ļ�ѧ����ʽ��Ba��OH��2+CO2�TBaCO3��+H2O |
| �� | B�� | ab����cd���������ķ�Ӧ��ͬ |
| �� | C�� | de�γ�������������BaCO3������ʧ�� |
| �� | D�� | bc�η�Ӧ�����ӷ���ʽ��2AlO2��+3H2O+CO2�T2Al��OH��3��+CO32�� |
| þ��������Ҫ�����. | |
| ר�⣺ | Ԫ�ؼ��仯��� |
| ������ | ֻҪͨ��CO2�����̾��г���BaCO3���������ȷ�����ӦBa��OH��2+CO2=Ba CO3��+H2O����Ba��OH��2������ϣ�����������KOH��������Ӧ2KOH+CO2=K2CO3+H2O������˶γ����������ֲ��䣬Ȼ���������������Ӧ2AlO2��+3H2O+CO2=2Al��OH��3��+CO32�����������������ٷ���CO32��+CO2+H2O=HCO3�����������ӦBaCO3+CO2+H2O=Ba��HCO3��2�����������ܽ⣬�Դ������ |
| ��� | �⣺ֻҪͨ��CO2�����̾��г���BaCO3���������ȷ�����ӦBa��OH��2+CO2=Ba CO3��+H2O����Ba��OH��2������ϣ�����������KOH��������Ӧ2KOH+CO2=K2CO3+H2O������˶γ����������ֲ��䣬Ȼ���������������Ӧ2AlO2��+3H2O+CO2=2Al��OH��3��+CO32�����������������ٷ���CO32��+CO2+H2O=HCO3�����������ӦBaCO3+CO2+H2O=Ba��HCO3��2�����������ܽ⣬ A��������������֪��Oa������Ӧ��Ba��OH��2+CO2=BaCO3��+H2O����A��ȷ�� B��������������֪��ab�η���2OH��+CO2�TCO32��+H2O��cd�η���CO32��+CO2+H2O=HCO3�������η�Ӧ����ͬ����B���� C��de�η�����ӦBaCO3+CO2+H2O=Ba��HCO3��2�����³����ļ��٣���C��ȷ�� D��������������֪��bc�η�Ӧ�����ӷ���ʽ�ǣ�2AlO2��+3H2O+CO2=2Al��OH��3��+CO32������D��ȷ�� ��ѡB�� |
| ������ | ������ͼ������ʽ���鷴Ӧ�Ⱥ�˳�����⣬Ϊ��Ƶ���㣬���ضԻ���֪ʶ���ۺϿ��飬����Ԫ�ػ��������ʼ������ķ�Ӧ��ͼ���뷴Ӧ�Ķ�Ӧ��ϵ�ǹؼ��Ĺؼ�����Ŀ�Ѷ��еȣ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��Z��W��Ԫ�����ڱ���ԭ������������������ֶ�����Ԫ�أ��������Ϣ���±���
| Ԫ�� | �� �� �� Ϣ |
| X | X������������Ӧ��ˮ���ﻯѧʽΪH2XO3 |
| Y | Y�ǵؿ��к�����ߵ�Ԫ�� |
| Z | Z�Ļ�̬ԭ�����������Ų�ʽΪ3s23p1 |
| W | W��һ�ֺ��ص�������Ϊ28��������Ϊ14 |
��1��Wλ��Ԫ�����ڱ��� ���ڵ� �壻W��ԭ�Ӱ뾶��X�� �����С������
��2��Z�ĵ�һ�����ܱ�W�� �����С������ XY2�ɹ�̬��Ϊ��̬����˷��������������� ����Ԫ�ء�X��Y��ԭ�ӿɹ�ͬ�γɶ��ַ��ӣ�д������һ�����γ�ͬ�ַ��Ӽ�������������� ��
��3�����£���Z���������ᷴӦ�����ɫ��Һ�еμ�NaOH��Һֱ���������ܹ۲쵽��������
��W�ĵ���������ᷴӦ�� ��������ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽ�� ��
��������ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽ�� ��
��4����25�桢101Kpa�£���֪13.5g��Z���嵥����Y2��������ȫȼ�պ�ָ���ԭ״̬������419KJ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����CH3OH(g)��H2O(g)===CO2(g)��3H2(g)����H����49.0 kJ·mol��1
��CH3OH(g)��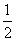 O
O 2(g)===CO2(g)��2H2(g) ��H����192.9 kJ·mol��1
2(g)===CO2(g)��2H2(g) ��H����192.9 kJ·mol��1
����˵����ȷ���� (����)��
A��CH3OHת���H2�Ĺ���һ��Ҫ��������
B���ٷ�Ӧ�У���Ӧ�������������������������
C�����ݢ���֪��Ӧ��CH3OH(l)��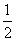 O2(g)===CO2(g)��2H2(g)�Ħ�H>��192.9 kJ·mol��1
O2(g)===CO2(g)��2H2(g)�Ħ�H>��192.9 kJ·mol��1
D����Ӧ���е������仯����ͼ��ʾ
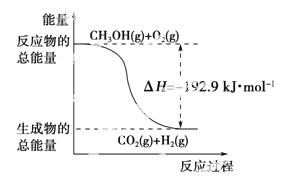
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��̽����ˮ�ɷֵ�ʵ���У����и���ʵ������ó��Ľ��۴�����ǣ�������
| ʵ����� | ʵ������ | ʵ����� |
| A | ��ˮ��dz��ɫ | ��ˮ�к��к���Cl2 |
| B | ��FeCl2��Һ�еμ���ˮ����Һ����ػ�ɫ | ��ˮ�к���HClO |
| C | ����ˮ�еμ������ữ��AgNO3��Һ��������ɫ���� | ��ˮ�к���Cl�� |
| D | ����ˮ�м���NaHCO3��ĩ�������ݲ��� | ��ˮ�к���H+ |
| �� | A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ʵ�����þ������Ͼ��Ⱥ�Ϊ�������ķݣ��ֱ�ӵ�������������Һ�У���ַ�Ӧ�ų����������ǣ�������
| �� | A�� | 3 mol•L��1HCl��Һ | B�� | 3 mol•L��1HNO3��Һ |
| �� | C�� | 8 mol•L��1NaOH��Һ | D�� | 18 mol•L��1ŨH2SO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���Ṥҵ�з�����Ϊ����������ɷ�ΪSiO2��Fe2O3��Al2O3��MgO��ij̽����ѧϰС���ͬѧ������·����������������н���Ԫ�ص���ȡʵ�飮

��֪��ҺpH=3.7ʱ��Fe3+�Ѿ�������ȫ��һˮ�ϰ����볣��Kb=1.8��10��5���䱥����Һ��c��OH����ԼΪ1��10��3mol•L��1����ش�
��1��д��A������������Һ��Ӧ�Ļ�ѧ����ʽ��������
��2����������������ʹ���Լ��٣��Ʋ��Լ���Ӧ������A������������ĸ��ţ�
A���������ơ����������� B�������������������� ���� C����ˮ������������ ��D��ˮ
��3����ҺD������E��������Ҫ������ҺpH=13�����pH��С�����ܵ��µĺ��������������дһ�㣩
��4������EΪ������д����ҺFͨ�����CO2���ɹ���G����ҺH�Ļ�ѧ����ʽ��������
��5��������ҺF��c��Mg2+��=������25��ʱ��������þ��Ksp=5.6��10��12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й����ʵ����ʺ����ʵ�Ӧ�þ���ȷ����
A��Ũ���������ˮ�ԣ������ڸ��ﰱ����������̼������
B�������������Ư���ԣ������ڼӹ�ʳƷʹʳƷ����
C�����������õĵ����ԣ��ֿ���ǿ�ȴ�о�����߿�����Զ�����ѹ����߲���
D��ͭ�Ľ�����Ա�����������ͭ������������Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1����CaSO4����O2��ȼ��CO��Ӧ���ȿ����ȼ��Ч�ʣ����ܵõ��ߴ�CO2����һ�ָ�Ч����ࡢ���õ�����ȼ�ռ�������Ӧ��Ϊ����Ӧ����Ӧ�ں͢�Ϊ����Ӧ��
��1/4CaSO4(s)+CO(g)  1/4CaS(s)+CO2(g) ∆H1
1/4CaS(s)+CO2(g) ∆H1
��CaSO4(s)+CO(g)  CaO(s)+CO2(g) +SO2(g) ∆H2
CaO(s)+CO2(g) +SO2(g) ∆H2
��CO(g)  1/2C(s)+1/2CO2(g) ∆H3
1/2C(s)+1/2CO2(g) ∆H3
��Ӧ2CaSO4(s)+7CO(g)  CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)��∆H��
CaS(s)+CaO(s)+6CO2(g)+C(s) +SO2(g)��∆H��
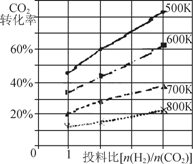 ����∆H1��∆H2��∆H3��ʾ��
����∆H1��∆H2��∆H3��ʾ��
��2����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��
2CO2(g)��6H2(g)  CH3OCH3(g)��3H2O(g)����H
CH3OCH3(g)��3H2O(g)����H
�ٸ÷�Ӧƽ�ⳣ������ʽΪK�� ��
����֪��ijѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ��
��ʱ��CO2��ת��������ͼ��ʾ���÷�Ӧ�Ħ�H
____(�������������=��)0�����¶Ȳ��䣬��
С��ӦͶ�ϱ�[n(H2) /n(CO2)]����K�� (�������С�����䡱)��
�۶�����ȼ�ϵ�ؾ��������죬Ч�ʸߵ��ŵ㣬�������Ϊ���ԣ�������ȼ�ϵ�صĸ�����ӦΪ ��
��3��һ����ͭ�����������������������̣�
����ͭ����������ɹ�ҵβ����SO2�IJ��ִ���������������ӦΪ��
2SO2��2nCu��(n��1)O2��(2��2n) H2O��2nCuSO4��(2��2n) H2SO4
 �ӻ��������ĽǶȿ��������������Ϊ
�ӻ��������ĽǶȿ��������������Ϊ
��
��������ͼ��ʾ�绯ѧװ��������һ����SO2��
�����Cu��������д��װ������������Ӧ��
�ܵ����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������¿�ʵ����ͼ��ʾ����֮��ı仯��
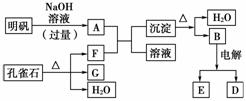
����д���пհף�
(1)��ȸʯ����Ҫ�ɷ���CuCO3��Cu(OH)2(��ʽ̼��ͭ)�������ֽ⣬��ͼ�е�F��________��
(2)д�����������NaOH��Һ��Ӧ�����ӷ���ʽ��
________________________________________________________________________
________________________________________________________________________��
(3)ͼ������G��D���ǹ��壬��Ϻ��ڸ����¿ɷ�����Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��____________________________��
(4)ÿ����1 mol D��ͬʱ����________mol E��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com