
(18分)(1)1 mol O2与足量氢气反应产生水蒸气放热483.6 kJ,若1 g水蒸气转化成液态水放热2.444 kJ,请写出表示氢气燃烧热的热化学方程式:__________________________________。
(2)由汽油裂解得到乙烯、丙烯是重要的化工原料,请写出下列转化的方程式,并注明反应类型。
丙烯 → 聚丙烯
___________________________________________________
(3)将N2、H2置于容积为2L的密闭容器中,发生反应,反应进行到4S末,测得N2 2mol 、H21.5mol、NH32mol。则用氮气浓度的减少来表示该反应速率为__________ 。
(4)在500ml密闭容器中,将2mol A和1molB混合加热到500℃,达到平衡
2 A(g) +B (g) 3C (g) K =
16求A转化为C的转化率为__________。
3C (g) K =
16求A转化为C的转化率为__________。
(5) 在密闭容器中发生下列反应:aA(g)  cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a
_______ c+d(填“>”、“=”或“<”)。
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,A的浓度为原平衡的2.1倍,则 a
_______ c+d(填“>”、“=”或“<”)。
(6) 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,反应的化学方程式为______________________________________

H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1

0.125mol/(L.S) 57.1%
< 2N M
M
【解析】(1)燃烧热是指再一定条件下,1mol可燃物完全燃烧,生成稳定的氧化物时所放出的热量,根据题意可知,1mol氢气完全燃烧生成水蒸气时放出的热量是483.6 kJ÷2=241.8 kJ。又因为1 g水蒸气转化成液态水放热2.444 kJ,所以18g水蒸气转化为液态水放出的热量是2.444 kJ×18=44kJ,所以氢气的燃烧热是(241.8+44)kJ/mol,则相应的热化学方程式为H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1。
(2)丙烯中含有碳碳双键,能发生加聚反应,方程式为 。
。
(3)生成氨气是2mol,则消耗氮气是1mol,所以氮气的反应速率是 =0.125mol/(L.S)。
=0.125mol/(L.S)。
(4)
2 A(g) +B (g) 3C (g)
3C (g)
起始浓度(mol/L) 4 2 0
转化浓度(mol/L) 2x x 3x
平衡浓度(mol/L) 4-2x 2-x 3x
所以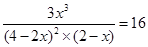
解得x=1.142
因此转化率是1.142÷4×100%=57.1%。
(5)将气体体积压缩到原来的一半的瞬间,A的浓度为原平衡的2倍,但平衡时A的浓度为原平衡的2.1倍,说明增大压强平衡向逆反应方向移动,所以a小于 c+d。
(6)根据图像可知,反应进行到t1时,N减少了2mol,M增加1mol,所以根据变化量之比是相应的化学计量数之比可知,方程式为2N M。
M。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源:浙江省诸暨中学2011-2012学年高一上学期期中考试化学试题(实验班) 题型:022
1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的O=O分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放________kJ的能量.
查看答案和解析>>
科目:高中化学 来源:江西省上高二中2011-2012学年高一下学期第二次月考化学试题 题型:022
Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中![]() =________
=________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:________
(3)平衡时,N的转化率为________.
(4)下列叙述中能说明上述反应达到平衡状态的是________
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
Ⅱ、(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143 kJ·g-1.则燃烧1 mol H2放出的热量为________kJ.
(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的O=O分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放________kJ的能量.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年度陕西省宝鸡中学上学期高二期末考试化学试卷 题型:填空题
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013届度陕西省上学期高二期末考试化学试卷 题型:填空题
化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据:
H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1,
H—O:464 kJ·mol-1。
(1)试根据这些数据计算下面这个反应的反应热:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。
(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。
(3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com