
 向50mL1mol/L的AlCl3溶液中加入0.2mol/L的NaOH溶液,生成沉淀1.56g,需NaOH溶液多少mL?(根据上题你认为NaOH溶液的体积应该分几种情况)
向50mL1mol/L的AlCl3溶液中加入0.2mol/L的NaOH溶液,生成沉淀1.56g,需NaOH溶液多少mL?(根据上题你认为NaOH溶液的体积应该分几种情况)| 1.56g |
| 78g/mol |
| 0.06mol |
| 0.2mol/L |
| 0.18mol |
| 0.2mol/L |


科目:高中化学 来源: 题型:
| A、加入过量的K2CO3溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
| B、加入过量的K2SO4溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
| C、加入过量的Na2CO3溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
| D、加入过量的Na2SO4溶液,过滤,除去沉淀,滤液中补加适量硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前者多 | B、后者多 |
| C、一样多 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①②④ |
| C、①②③④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
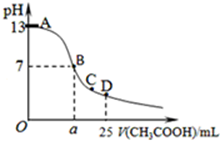 某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是| A、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com