
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
分析 A.同周期自上而下,元素非金属性减弱,非金属性越强,单质氧化性越强,氢化物还原性越弱;
B.同周期自左而右金属性减弱、非金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,非金属性越强,最高价含氧酸的酸性越强;
C.还原性强弱与得失电子数目多少无关,与失去电子难易程度有关;
D.同主族自上而下原子半径增大,元素非金属性减弱,单质氧化性减弱.
解答 解:A.从氟到碘,同周期自上而下,元素非金属性减弱,单质氧化性减弱,氢化物还原性增强,故A正确;
B.同周期自左而右金属性减弱、非金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,非金属性越强,最高价含氧酸的酸性越强,故从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强,故B正确;
C.还原性强弱与得失电子数目多少无关,与失去电子难易程度有关,Na比Al容易失去电子,钠比铝的还原性强,故C错误;
D.同主族自上而下原子半径增大,元素非金属性减弱,单质氧化性减弱,故氧比硫的原子半径小,氧气比硫的氧化性强,故D正确,
故选C.
点评 本题考查元素周期律,难度不大,注意掌握同主族元素化合物性质相似性与递变性,注意金属的金属性强弱与失电子多少无关,与失电子难易程度有关,易错选项是C.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 |  CuSO4溶液 | 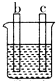 稀硫酸 | 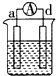 稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.
CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
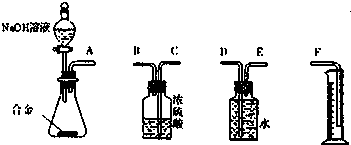
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com