
| A、硝酸为弱电解质 |
| B、该溶液1 mL稀释至100 mL后,pH小于3 |
| C、向该溶液中加入等体积、等浓度的氢氧化钡溶液,混合后溶液pH=7 |
| D、该溶液中水电离出的c(H+)=1×10-13 mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.03mol |
| B、0.02mol |
| C、大于0.02mol |
| D、小于0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、240 mL 0.2 mol?L-1的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器 |
| B、向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体 |
| C、不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗 |
| D、用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
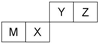
| A、X 的最简单气态氢化物的热稳定性比Z的小 |
| B、Z位于元索周期表中第2周期、第ⅥA族 |
| C、原子半径Z<M |
| D、Y的最高价氧化物对应水化物的酸性比X 的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 观察下列结构简式,回答下列问题:
观察下列结构简式,回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:
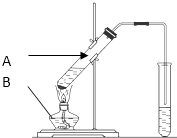
查看答案和解析>>
科目:高中化学 来源: 题型:
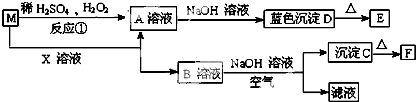
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、在上述条件下,SO2不可能100%地转化为SO3 |
| C、为了提高SO2的转化率,应适当提高O2的浓度 |
| D、达到平衡时,SO2的浓度与SO3的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
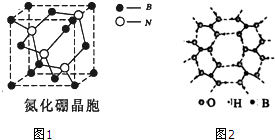 物质结构决定物质的性质,物质性质反映了物质结构.
物质结构决定物质的性质,物质性质反映了物质结构.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com