

| A、该反应能量变化类型与CaCO3分解反应相同 |
| B、加催化剂后,正反应速率加快,逆反应速率减少 |
| C、反应热△H=E2-E1 |
| D、若该反应为氧化还原反应,则可以将其设计成原电池 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、v(B2)=0.8mol?L-1?S-1 |
| B、v(B2)=0.42mol?L-1?S-1 |
| C、v(C)=0.6mol?L-1?S-1 |
| D、v(A2)=0.4mol?L-1?S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀盐酸的反应 |
| B、Ba(OH)2.8H2O与NH4Cl的反应 |
| C、灼热的炭与CO2的反应 |
| D、甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| △ |
| 化学键 | H-Cl | O=O | Cl=Cl | H-O |
| 键能/kJ.mol-1 | 431 | 498 | 243 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18.0L |
| B、27.0L |
| C、31.4L |
| D、33.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,Ph=12的NaOH溶液中含有OH-的数目为0.01NA |
| B、1L 0.25mol.L-1醋酸溶液中含CH3COOH分子数为0.25NA |
| C、7.8gNa2O2中阴阳离子总数为0.4NA |
| D、标准状况下,2.24L氧气与氮气的混合气体所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、该反应是氧化还原反应 |
| B、MnO2发生还原反应 |
| C、HCl是还原剂 |
| D、若生成7.1 g Cl2,则转移0.1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属元素的原子最外层电子数越少,则该元素的金属性越强 |
| B、同周期元素原子半径和离子半径从左到右均依次减小 |
| C、第三周期非金属氧化物对应水化物的酸性从左到右依次增强 |
| D、第ⅦA族元素气态氢化物的还原性从上到下依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
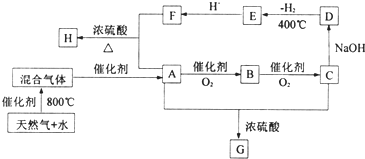
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com