
分析 (1)电解时阴极是阳离子得到电子发生还原反应,镁离子得到电子生成镁单质;
(2)依据溶液中的溶度积计算铁离子浓度;
(3)氯化铝是共价化合物,熔融固体不能电离出阴阳离子;
(4)碳棒做电极电解熔融氧化铝,阳极上氧离子失电子发生氧化反应生成氧气,氧气和碳反应生成二氧化碳,消耗电极需要定期补充;
(5)根据Al2O3(熔融1)=2Al(s)+$\frac{3}{2}$O2(g)△H=+1600kJ•mol-1,则生成27gAl即1mol时要吸收$\frac{1600}{2}$=800KJ的热量,据此计算;
(6)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,氢氧化铝具有净水作用,向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时硫酸铝钾和氢氧化钡物质的量之比等于1:2反应生成硫酸钡沉淀、偏铝酸钾和水;
(7)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl或MgO,依据原子守恒书写化学方程式;
解答 解:(1)电解熔融MgCl2可得到金属镁,镁离子在阴极放电,电极反应方程式为:Mg2++2e-=Mg,故答案为:Mg2++2e-=Mg;
(2)除去MgCl2溶液中的Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后加入少量碱性物质至溶液pH=4,c(H+)=10-4mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$=10-10mol/L,此时c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{4×1{0}^{-38}}{(1{0}^{-10})^{3}}$=4×10-8,
故答案为:4×10-8;
(3)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,不采用电解熔融AlCl3的方法是因为氯化铝是共价化合物,固体熔融会升华,不能得到阴阳离子,不能发生电解反应得到金属铝,氯化铝溶于水完全电离属于电解质,故答案为:C;
(4)碳棒做电极电解熔融氧化铝,阳极上氧离子失电子发生氧化反应生成氧气,电极反应为:2O2--4e-=O2,在冶炼过程中,阳极材料碳被氧气氧化成一氧化碳,反应为C+O2$\frac{\underline{\;高温\;}}{\;}$CO2或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO,所以需定期地进行更换,
故答案为:2O2--4e-=O2,C+O2$\frac{\underline{\;高温\;}}{\;}$CO2或2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO;
(5)由Al2O3(熔融1)=2Al(s)+$\frac{3}{2}$O2(g)△H=+1600kJ•mol-1,则生成27gAl即1mol时要吸收$\frac{1600}{2}$=800KJ的热量,所以电解过程中能量利用率为$\frac{80}{1000}$×100%=80%,故答案为:80%;
(6)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,氢氧化铝具有净水作用,即Al3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3(胶体)+3H+,向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时硫酸铝钾和氢氧化钡物质的量之比等于1:2反应生成硫酸钡沉淀、偏铝酸钾和水;偏铝酸钾溶液中水解溶液显碱性,溶液PH>7,
故答案为:Al3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3(胶体)+3H+,>;
(7)若在空气中加热MgCl2•6H2O,可生成Mg(OH)Cl或MgO,依据原子守恒书写化学方程式为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑;氯化镁水解显酸性,氯化氢气流中加热防止水解,HCl气流可抑制Mg2+水解;
故答案为:MgCl2•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑;HCl;
点评 本题考查了常见化合物性质、电解原理、盐类水解应用、溶度积常数的计算,是考查重点,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸滴在石灰石上:CO32-+2H+═H2O+CO2↑ | |
| B. | 少量CO2通入氢氧化钠溶液中:2OH-+CO2═CO32-+H2O | |
| C. | NaOH溶液和NaHSO4溶液反应:HSO4-+OH-═SO42+H2O | |
| D. | 稀H2SO4滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入1mol N2和3mol H2,充分反应生成NH3分子数为2NA | |
| B. | 0.1mol-NH2(氨基)中含有的电子数为0.7NA | |
| C. | 30g SiO2中含有的Si-O键数目为2NA | |
| D. | 标准状况下,4.48 L N2所含的共用电子对数0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
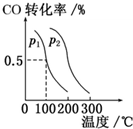 联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的离子方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为5:3 | |
| C. | 上述苛性钾溶液中含有0.3mol的KOH | |
| D. | 反应后生成的ClO-和 ClO3- 两种离子在一定条件下均有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,请补充完整:
,请补充完整:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、NO3-、MnO4- | B. | Na+、NO3?、SO42?、I? | ||
| C. | K +、Fe3+、Cl-、Br- | D. | Ba2+、Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com