
| A、生物质能来源于植物及其加工产品贮存的能量,不包括农业废弃物、动物粪便等 |
| B、密闭容器可逆反应N2+3H2?2NH3达到平衡后,增加氮气,氢气的转化率一定增大 |
| C、平衡常数发生变化,化学平衡必定发生移动,达到新平衡 |
| D、废弃的电池、金属制品属于不可回收再利用的资源 |


科目:高中化学 来源: 题型:
A、钾(K)原子基态的原子结构示意图为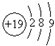 |
B、H2O电子式为 |
| C、Mg的原子基态电子排布式为1s22s22p63s23p1 |
| D、Ca原子基态电子排布式为1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)?c(OH-)比值不变 |
| B、溶液pH增大 |
| C、c(OH-)降低了 |
| D、水电离出的c(H+)增加了 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Va>Vb时:c (CH3COOH)+c (CH3COO-)>c (K+) |
| B、Va=Vb时:c (CH3COOH)+c (H+)=c (OH-) |
| C、Va<Vb时:c (CH3COO-)>c (K+)>c (OH-)>c (H+) |
| D、Va与Vb任意比时:c (K+)+c (H+)=c (OH-)+c (CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1=△H2=-92.4 kJ/mol |
| B、-92.4 kJ/mol<△H1<△H2 |
| C、△H1<△H2<-92.4 kJ/mol |
| D、△H1=△H2<-92.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、接触法制硫酸中采用沸腾炉的目的是为了使硫磺或黄铁矿燃烧充分,提高原料的利用率 |
| B、合成氨生产过程中采用高温高压条件都是为了提高N2、H2的转化率 |
| C、硫酸工业中,在接触室安装热交换器是为了利用硫磺或黄铁矿燃烧时放出的热量 |
| D、在联合制碱法中,参与循环的物质有CO2和NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO过量 |
| B、CO与铁矿石接触不充分 |
| C、炼铁高炉的高度不够 |
| D、CO与Fe2O3的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com