
| A、用弱酸的电离平衡常数比较同温同物质的量浓度下强碱弱酸盐溶液的碱性强弱 |
| B、常温下pH=2的盐酸、氯化铵两种溶液中,水的电离程度相同 |
| C、用化学反应平衡常数推断该化学反应的剧烈程度 |
| D、将等体积、等pH的氢氧化钠溶液和氨水溶液分别稀释相同倍数,氨水的pH变化大 |


科目:高中化学 来源: 题型:
| 被提纯物质 | 除杂试剂(操作) | 分离方法 | |
| A | 溴乙烷(Br2) | Na2SO3溶液 | 分液 |
| B | NH4Cl(I2) | 加热 | 升华 |
| C | 乙烷(乙烯) | 酸性KmnO4溶液 | 洗气 |
| D | Al(OH)3胶体(N aCl固体) | 溶于水 | 抽滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天平左盘放砝码,右盘放固体 |
| B、容量瓶使用时含有少量的蒸馏水 |
| C、定容时水加多了 |
| D、定容时俯视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度℃ | 25 | 80 |
| 平衡常数 | 5×104 | 2 |
| A、上述反应的正反应为吸热反应 |
| B、25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数也为5×104 |
| C、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为1mol.L-1,则此时v(正)>v(逆) |
| D、达平衡后,在容器中再加入一定的Ni粉,则平衡会向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=5.0mol?L-1?min-1 |
| B、v(B)=2.0mol?L-1?min-1 |
| C、v(C)=0.9mol?L-1?s-1 |
| D、v(D)=1.0mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
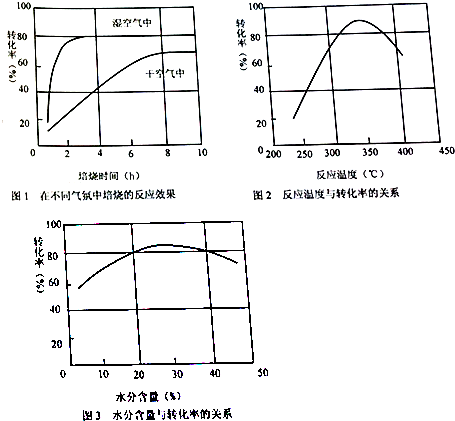
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 样品的质量/g | KmnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com