
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1 mol H2O中的氢原子数目为2NA | |
| C. | 阿伏加德罗常数个粒子的物质的量是1mol | |
| D. | 1mol NH3所含原子数约为2.408×1024个 |
分析 A、阿伏伽德罗常数的单位为mol-1;
B、水由2个氢原子和1个氧原子构成;
C、将阿伏伽德罗常数个微粒看做一个整体,即为1mol;
D、1mol氨气含4mol原子.
解答 解:A、阿伏伽德罗常数的单位为mol-1,即阿伏伽德罗常数为6.02×1023mol-1,故A错误;
B、水由2个氢原子和1个氧原子构成,故1mol水中含2mol氢原子,即2NA个,故B正确;
C、将阿伏伽德罗常数个微粒看做一个整体,即为1mol,故阿伏伽德罗常数个微粒即为1mol,故C正确;
D、1mol氨气含4mol原子,即为2.408×1024个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的单位以及物质中微粒个数的计算,难度不大.


科目:高中化学 来源: 题型:填空题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2得电子,被氧化 | |
| B. | 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g | |
| C. | 电流是由PbO2经外电路流向Pb | |
| D. | 电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
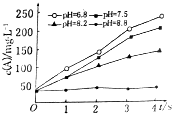 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )| A. | 若增大压强,该反应的反应速率一定增大 | |
| B. | pH=6.8时,随着反应的进行反应速率逐渐增大 | |
| C. | 一定pH范围内,溶液中H+浓度越小反应速率越快 | |
| D. | 可采用调节pH的方法使反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| B. | 已知酸性HF>CH3COOH,则pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-)=c(K+)-c(CH3COO-) | |
| C. | 0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸pH=b,则a+1=b | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl-) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com