
【题目】将一定量的晶体A(NH4HC2O4)隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体.这四种物质与其他的相互转化关系如图所示.F和J是中学化学中常见的两种单质.H为红棕色气体.图中部分反应条件及生成物没有列出.请按要求填空:
(1)E的化学式为
(2)写出B和F反应的化学方程式 , L和B的水溶液反应的离子方程式;
(3)写出K与I的稀溶液反应的离子方程式
(4)标准状况下,将充满H的试管倒立在水槽中并通入适量的F,充分反应后液体充满试管,不考虑溶液中物质的扩散,则试管中溶液的物质的量浓度为:;
(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4 , 反应有G生成,该反应的化学方程式是 .
【答案】
(1)CO
(2)4NH3+5O2 ![]() 4NO+6H2O;Fe3++3 NH3?H2O=Fe(OH)3+3NH
4NO+6H2O;Fe3++3 NH3?H2O=Fe(OH)3+3NH ![]()
(3)3Fe3O4+28H++NO ![]() =9Fe3++NO↑+14H2O
=9Fe3++NO↑+14H2O
(4)![]() mol/L
mol/L
(5)2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
【解析】解:加热A(NH4HC2O4)分解得到等物质的量的四种气体,气体B与F反应得到G与D,F是中学化学中常见的单质,则G与F反应得到H为红棕色气体,则C为CO2 , F为O2 , B为NH3 , G为NO,D为H2O,H为NO2 , I为HNO3 . L与B的水溶液反应得到红褐色沉淀为Fe(OH)3 , D(H2O)与单质J在高温下反应,结合转化关系,根据Fe元素守恒可知,J为Fe,K为Fe3O4 , L为Fe(NO3)3 , E可K与反应生成Fe和CO2 , 则E具有还原性,则E为CO.(1)E的化学式为CO,所以答案是:CO;(2)B和F反应的化学方程式:4NH3+5O2 ![]() 4NO+6H2O, L和B的水溶液反应的离子方程式:Fe3++3 NH3H2O=Fe(OH)3+3NH4+ , 所以答案是:4NH3+5O2
4NO+6H2O, L和B的水溶液反应的离子方程式:Fe3++3 NH3H2O=Fe(OH)3+3NH4+ , 所以答案是:4NH3+5O2 ![]() 4NO+6H2O;Fe3++3 NH3H2O=Fe(OH)3+3NH
4NO+6H2O;Fe3++3 NH3H2O=Fe(OH)3+3NH ![]() ;(3)K与I的稀溶液反应的离子方程式:3Fe3O4+28H++NO
;(3)K与I的稀溶液反应的离子方程式:3Fe3O4+28H++NO ![]() =9Fe3++NO↑+14H2O,所以答案是:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O;(4)标准状况下,将充满NO2的试管倒立在水槽中并通入适量的O2 , 充分反应后液体充满试管,令NO2为1L,由N原子守恒可知生成硝酸为
=9Fe3++NO↑+14H2O,所以答案是:3Fe3O4+28H++NO3﹣=9Fe3++NO↑+14H2O;(4)标准状况下,将充满NO2的试管倒立在水槽中并通入适量的O2 , 充分反应后液体充满试管,令NO2为1L,由N原子守恒可知生成硝酸为 ![]() =
= ![]() mol,则试管中溶液的物质的量浓度为
mol,则试管中溶液的物质的量浓度为 ![]() mol/L,所以答案是:
mol/L,所以答案是: ![]() mol/L;(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4 , 反应有G(NO)生成,该反应的化学方程式是:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑,所以答案是:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑.
mol/L;(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4 , 反应有G(NO)生成,该反应的化学方程式是:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑,所以答案是:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑.


科目:高中化学 来源: 题型:
【题目】在0.5L某浓度的NaCl溶液中含有0.5mol Na+ , 下列对该溶液的说法中,不正确的是( )
A.该溶液的物质的量浓度为1molL﹣1
B.该溶液中含有58.5g NaCl
C.配制100mL该溶液需用5.85g NaCl
D.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( ) ①将金属Na投入水中:2Na+2H2O=2Na++2OH﹣+H2↑
②在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++OH﹣+H++SO ![]() =BaSO4↓+H2O
=BaSO4↓+H2O
③碳酸氢钙溶液中滴加盐酸:HCO ![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
④碳酸钙中滴加盐酸:CO ![]() +2H+=CO2↑+H2O.
+2H+=CO2↑+H2O.
A.①③④
B.①③
C.②④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下图所示A~F六种仪器,请根据要求填空.
(1)下列实验操作中用到仪器F的是(选填下列选项的编号字母).a.分离水和CCl4的混合物
b.分离水和酒精的混合物
c.分离水和泥沙的混合物
(2)实验室用浓盐酸配制100mL0.5molL﹣1的稀盐酸.①上述仪器中一定不会用到的是(填写仪器的编号字母)
②下列关于仪器E的使用方法中正确的是(填下列选项的编号字母).
a、使用前应检查是否漏液. b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d、热溶液可直接转移到容量瓶中
③下列操作会使所配溶液浓度偏高的是(填下列选项的编号字母).
a、没有将洗涤液转移到容量瓶 b.转移过程中有少量溶液溅出
c.定容后摇匀,液面下降,继续加水至刻度线 d.定容时俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g
Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g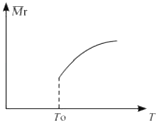
(1)SiCl4的平均反应速率为
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是( )
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiCl4(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在(填“T1”、“T2”、“T3”)温度下反应达到平衡所需时间最长:
温度T | T1 | T2 | T3 |
平衡常数K | 1.2 | 2.5 | 10 |
假设温度为T1时向该反应容器中同时加入.c(SiCl4)=0.3mol/L,c(H2)=0.3mol/L,c(N2)=x mol/L,c(HCl)=0.3mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值范围为
(4)该反应的原子利用率为
(5)工业上制备SiCl4的反应过程如下:
①SiO2(s)+2C(s)═Si(s)+2CO(g),△H═akJ/mol
②Si(s)+2Cl2(g)═SiCl4(l),△H=bkJ/mol
③SiCl4(g)═SiCl4(l),△H═ckJ/mol
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiCl4和一氧化碳的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铝与NaOH溶液反应:2Al+2H2O+2OH﹣=2AlO ![]() +3H2↑
+3H2↑
B.将一小块钠投入水中:Na+H2O=Na++OH﹣+H2↑
C.碳酸钙和盐酸反应:CO ![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C—C≡C—C≡C—C≡C—C≡N。下列对该物质的判断正确的是( )
A.属于不饱和烃
B.不能使酸性KMnO4溶液褪色
C.所有原子都在同一条直线上
D.可由乙炔和含氮化合物加聚制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体分子且键角都为109°28′
C. NaCl晶体中与每个Na+距离相等且最近的Na+共有8个
D. 单质的晶体中一定不存在的微粒是阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1 的是( )
A.2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2
B.S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2
C.C(s)+ ![]() O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2
O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2
D.2HCl(g)═H2(g)+Cl2(g)△H1 H2(g)+Cl2(g)═2HCl(g)△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com